研究テーマ
代謝と免疫の調節機構
核内受容体などによる生体の代謝・免疫調節のメカニズムを分子、細胞、個体レベルで研究しています。
核内受容体
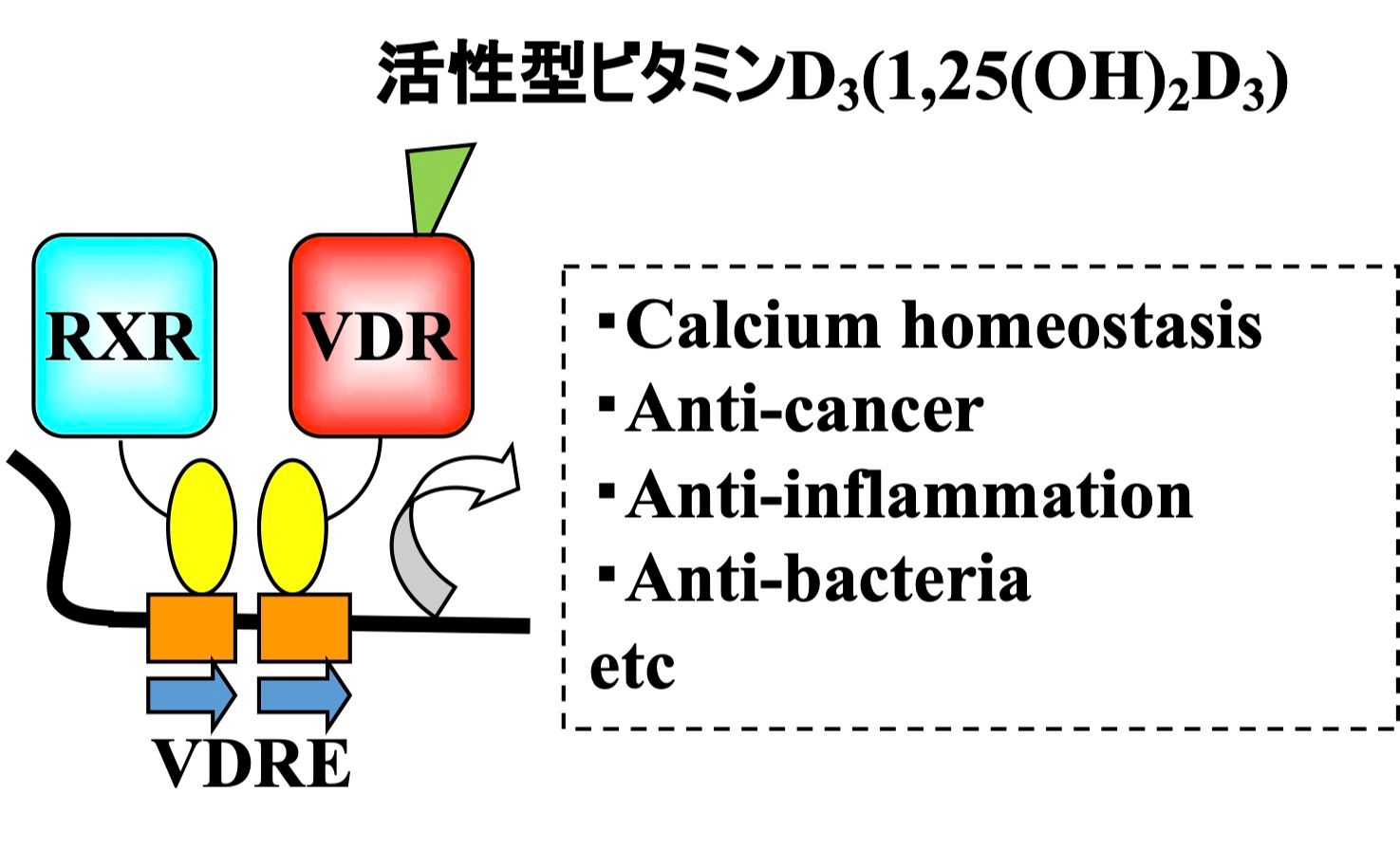
核内受容体は,リガンド結合領域とDNA 結合領域を有する転写因子です。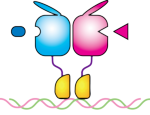
ヒトでは48種類の核内受容体が存在します。ステロイドホルモンや甲状腺ホルモンの受容体は核内受容体です(Makishima et al., J Pharmacol Sci 2005)。
- グルココルチコイド ー glucocorticoid receptor (GR)
- ミネラルコルチコイド ー mineralocorticoid receptor (MR)
- プロゲステロン(女性ホルモン) ー progesterone receptor (PR)
- エストロゲン(女性ホルモン) ー estrogen receptor (ER)
- アンドロゲン(男性ホルモン) ー androgen receptor (AR)
- 甲状腺ホルモン ー thyroid receptor (TR)
ビタミンAやビタミンDの受容体も核内受容体です。
- レチノイン酸(ビタミンA) ー retinoic acid receptor (RAR)
- 9-シスレチノイン酸(ビタミンA) ー retinoid X receptor (RXR)
- 1,25-ジヒドロキシビタミンD3(ビタミンD) ー vitamin D receptor (VDR)
ステロイドホルモンの受容体の遺伝子が最初に単離されましたが、その後遺伝子工学的な手法にて、次々と類似の構造の受容体が単離されました。しかし、多くがリガンド未同定のオーファン受容体でした。オーファン受容体のリガンド探索の研究により、核内受容体が生体の脂質代謝の重要な調節因子であることが明らかになりました。
- 脂肪酸 ー peroxisome proliferator-activated receptor (PPAR)
- オキシステロール(酸化コレステロール) ー liver X receptor (LXR)
- 胆汁酸 ー farnesoid X receptor (FXR)
ビタミンDと胆汁酸に反応するVDR
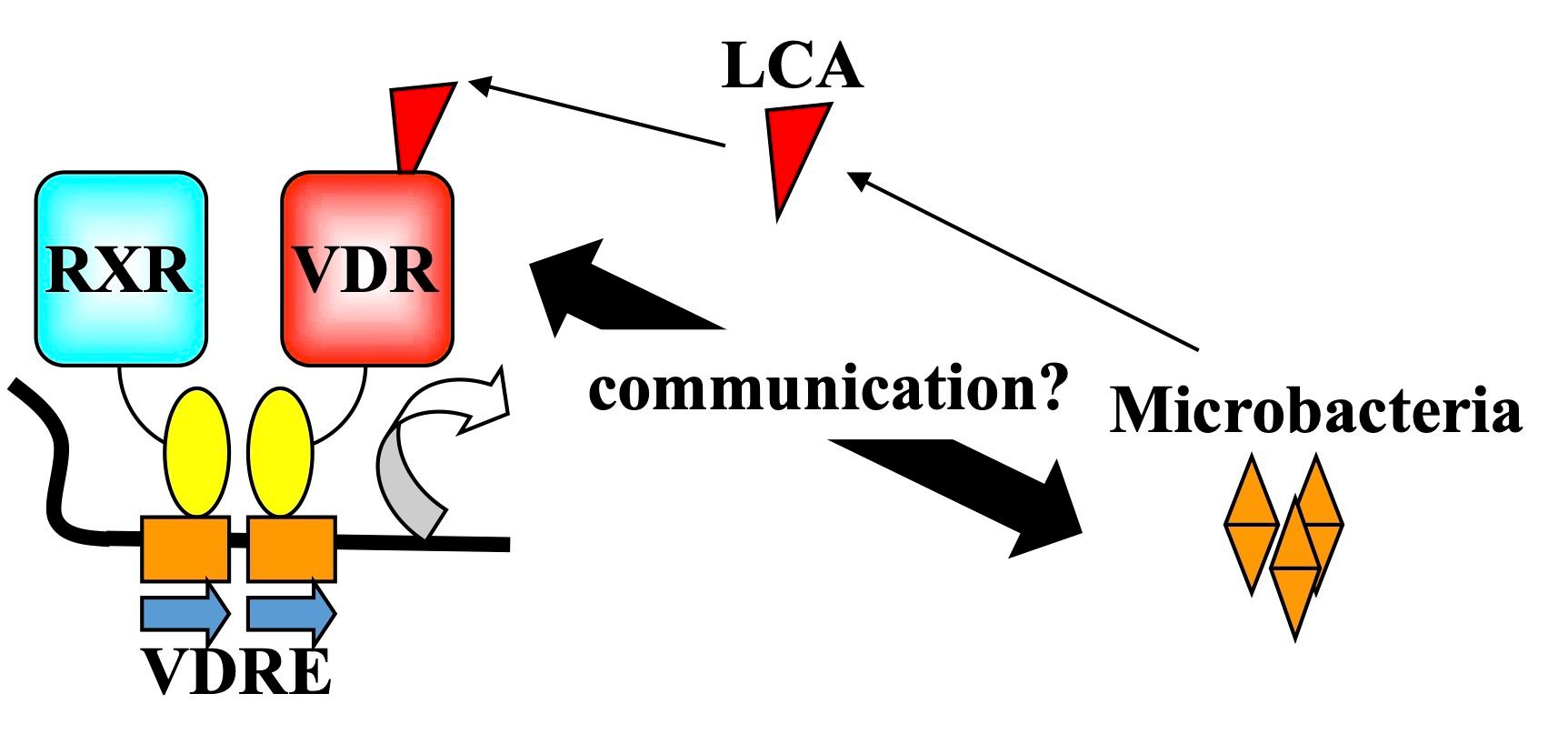
LXRがオキシステロールの受容体としてコレステロール代謝を調節し、胆汁酸受容体FXRは胆汁酸代謝を調節します(Makishima et al., Science 1999; Lu and Makishima et al, Mol Cell 2002)。ビタミンDの受容体VDRは、LXRやFXRに近い構造を有していることから、VDRも胆汁酸であるリトコール酸の受容体として機能することが明らかになりました(Makishima et al., Science 2002)。
私達は、ビタミンDの内分泌受容体、そして胆汁酸センサーとして機能するVDRの研究を行っています。これまでの研究で次のことを明らかにしました。
- 活性型ビタミンD3(1,25-ジヒドロキシビタミンD3)とリトコール酸とでは、異なった結合様式でVDRに作用する(Adachi et al., Mol Endocrinol 2004)。
- VDR活性化作用を増強したリトコール酸の誘導体の開発が可能である(Adachi et al., J Lipid Res 2005)。
- リトコール酸誘導体は、高カルシウム血症を引き起こさずに、組織VDRを活性化できる(Ishizawa et al., J Lipid Res 2008)。
- 活性型ビタミンD3とリトコール酸とでは、VDR-RXR-コファクター複合体の形成様式が異なる(Choi et al.,Mol Pharmacol 2011; Chuma et al., Biol Pharm Bull 2012)。
- 組織・細胞選択的なビタミンD誘導体の開発(Inaba et al., Mol Pharmacol 2007; Kudo et al., J Med Chem 2014; Watarai et al., J Med Chem 2015; Otero et al., J Med Chem 2018; Maekawa et al., Biomolecules 2023)。
- 腸管粘膜由来細胞において、p38αとGADD45Aが、活性型ビタミンD3依存性のカルシウムチャネルTRPV6の発現誘導に関与する(Ishizawa et al., Steroid Biochem Mol Biol 2017)。
- 腸管粘膜由来細胞において、亜鉛シグナルが、活性型ビタミンD3依存性のE-カドヘリン遺伝子の発現制御に選択的に関与する(Ishizawa et al., Anticancer Res 2021)。
がん、炎症・免疫疾患、心血管病変などにおいて、VDRリガンドの有用性が報告されています。私達は、リガンド選択的、作用選択的なVDR活性化機構を解明し、これらの疾患の治療・予防に応用できるリガンドの開発を目指しています。
胆汁酸代謝とVDR
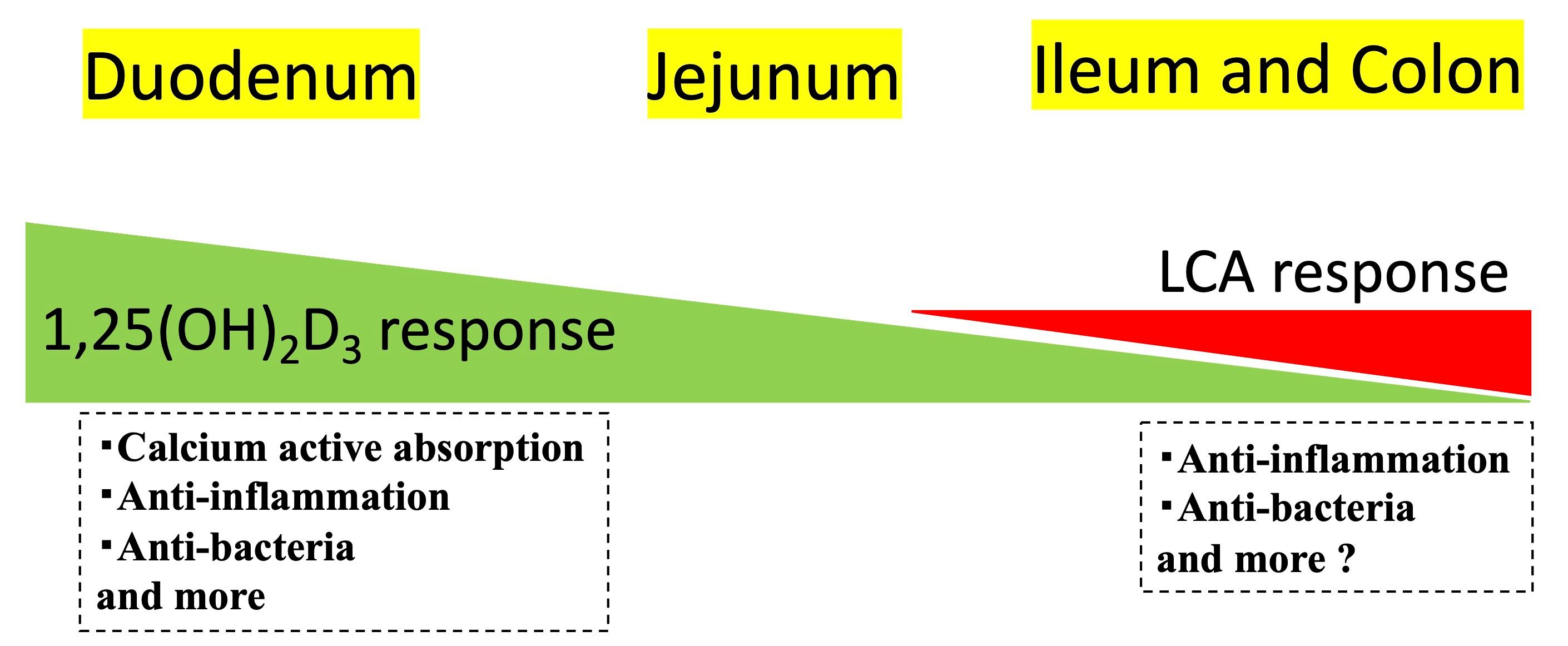
活性型ビタミンD3やリトコール酸によって活性化するVDRが、胆汁酸代謝や関連する生体現象にどのような影響を及ぼしているかを研究しています。下部消化管において腸内細菌が産生するリトコール酸がVDRを活性化する生物学的意義を含めて、VDRの非カルシウム作用の生体での役割を解析しています。
- ビタミンDの動物への投与は、胆汁酸の腎臓排泄を促進する(Nishida et al., Drug Metab Disp 2009)。
- ビタミンDの投与は、総胆管結紮による胆汁鬱滞における炎症反応を抑制する(Ogura et al., J Pharmacol Exp Ther 2009)。
- VDR欠損マウスの腸管は、炎症反応抵抗性のメカニズムを代償的に獲得している(Ishizawa et al., PLoS ONE 2012)。
- リトコール酸は下部腸管選択的にVDRを活性化する(Ishizawa et al., Int J Mol Sci 2018)。
- VDR欠損マウスでは、胆汁酸の糞中排泄が減少する(Nishida et al., J Nutr Sci Vitaminol 2020)。
- リトコール酸は、VDR依存性にマウス炎症性腸疾患を抑制する(Kubota et al., Int J Mol Sci 2023)。
胆汁酸代謝のみならず、生体の様々な代謝におけるVDRの役割を解析しています。VDRは、栄養素と生体機能を結びつける重要な因子であることが、明らかになりつつあります。
LXRリガンド
LXRは、生体のコレステロールバランスを負の方向へ誘導する代謝調節因子です。また、LXRは、炎症反応を抑制したり、マクロファージなどのアポトーシスや貪食能の調節にも関与すると報告されています。
- 植物ステロール誘導体が作用選択的なLXRリガンドとして作用する(Kaneko et al., J Biol Chem 2003)。
- LXRの活性化は、βカテニンシグナル系とクロストークする(Uno et al., Biochem Pharmacol 2009)。
- 7-デヒドロコレステロールのCYP27A1代謝産物がLXRリガンドとして作用する(Endo-Umeda et al., J Steroid Biochem Mol Biol 2014)。
- 7-デヒドロコレステロールの1α水酸化誘導体がLXRリガンドとして炎症反応を効果的に抑制する(Endo-Umeda et al., Steroid Biochem Mol Biol 2017)。
新規LXRリガンドを見いだし、選択的な作用を解析しています。
核内受容体の肝臓・消化管免疫系への影響
肝臓は食事由来の栄養成分や薬物、外来異物など多くの成分を受け入れる臓器として働くため、それらを監視するためにKupffer細胞やマクロファージ、リンパ球など様々な免疫細胞が存在し、代謝、炎症、生体防御、抗腫瘍活性などを制御しています。LXRは肝臓に高発現すること、VDRは肝細胞での発現は低いもののKupffer細胞などに発現すること、両受容体はともに脂質代謝と免疫制御に関与することから、それらの欠損マウスを用いて肝臓免疫細胞の機能解析や消化管免疫系への影響についての解析を行っています。
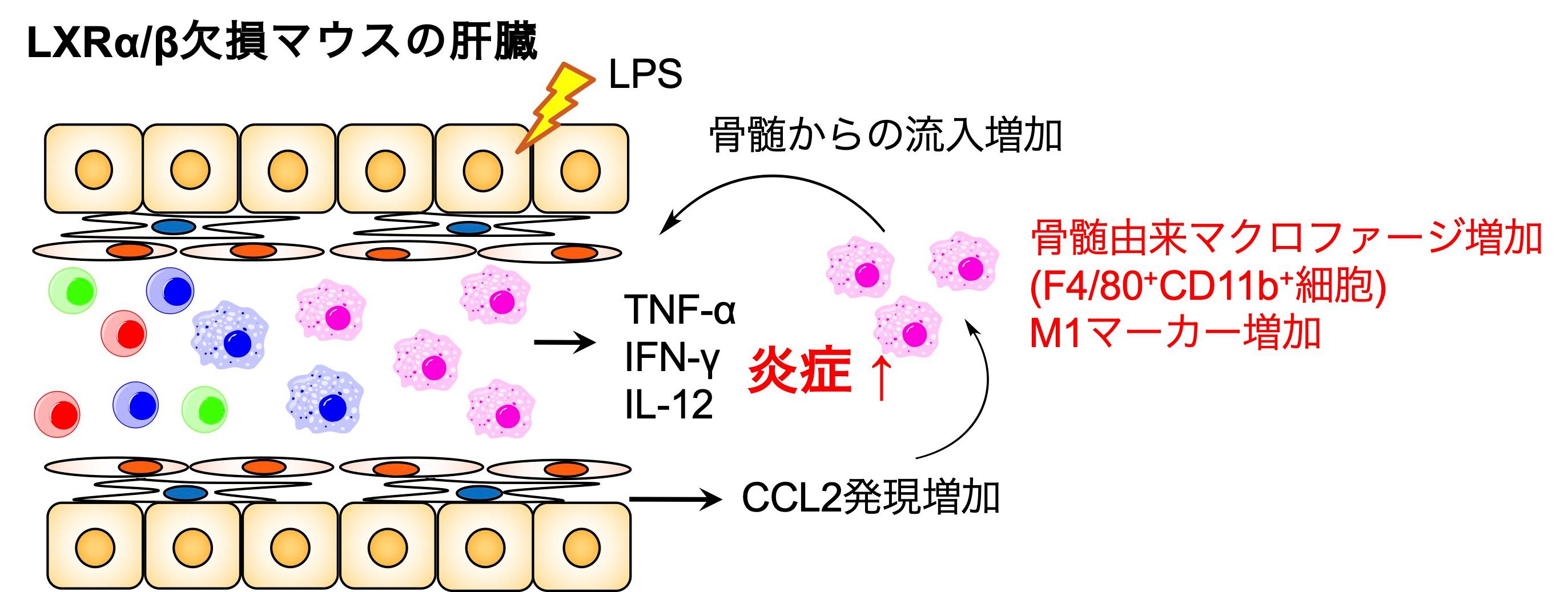
- LXRα/β欠損マウスの肝臓において炎症性マクロファージが増加し、炎症刺激に過敏となる(Endo-Umeda et. al., Sci Rep 2018; reviewed in Endo-Umeda and Makishima. Int J Mol Sci 2019)。
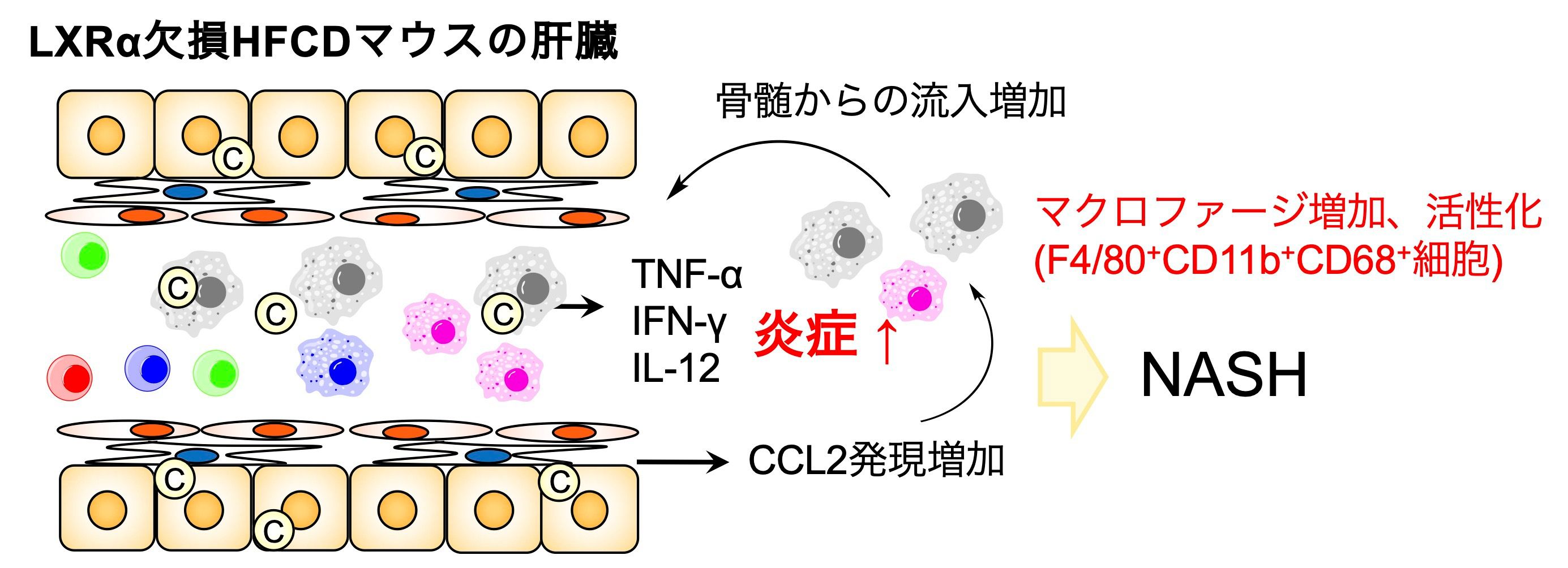
- LXRα欠損マウスにおいて高脂肪及び高コレステロール含有食を負荷すると肝臓への顕著なコレステロール蓄積に伴い活性型マクロファージの浸潤を認め、早期にNASHを発症する(Endo-Umeda et al., Endocrinology, 2018; reviewed in Endo-Umeda and Makishima. Int J Mol Sci 2019)。
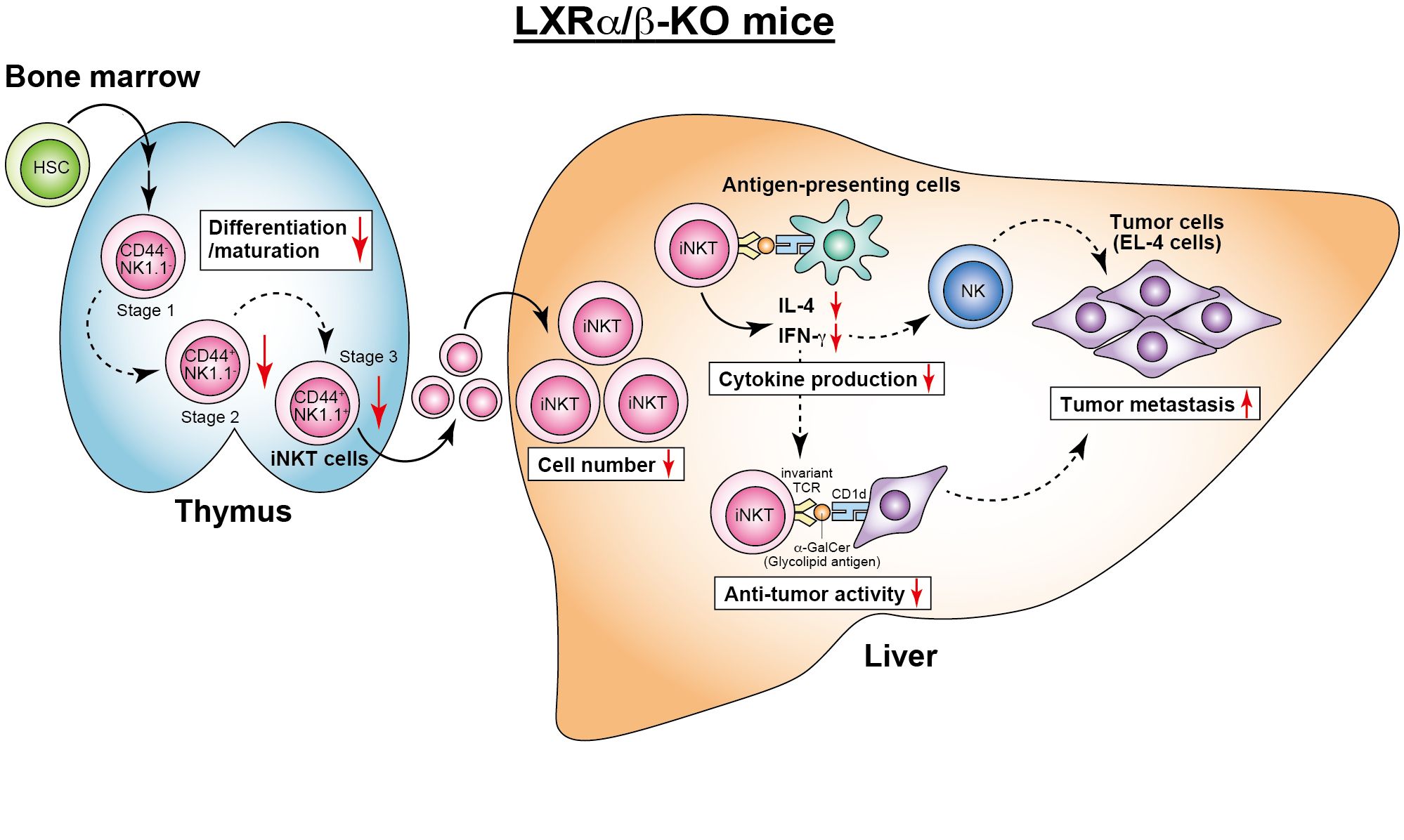
- LXRα/β欠損マウスにおいてナチュラルキラーT細胞が減少し、肝臓の抗腫瘍活性が障害される。(Endo-Umeda et al., Sci Rep, 2021)。
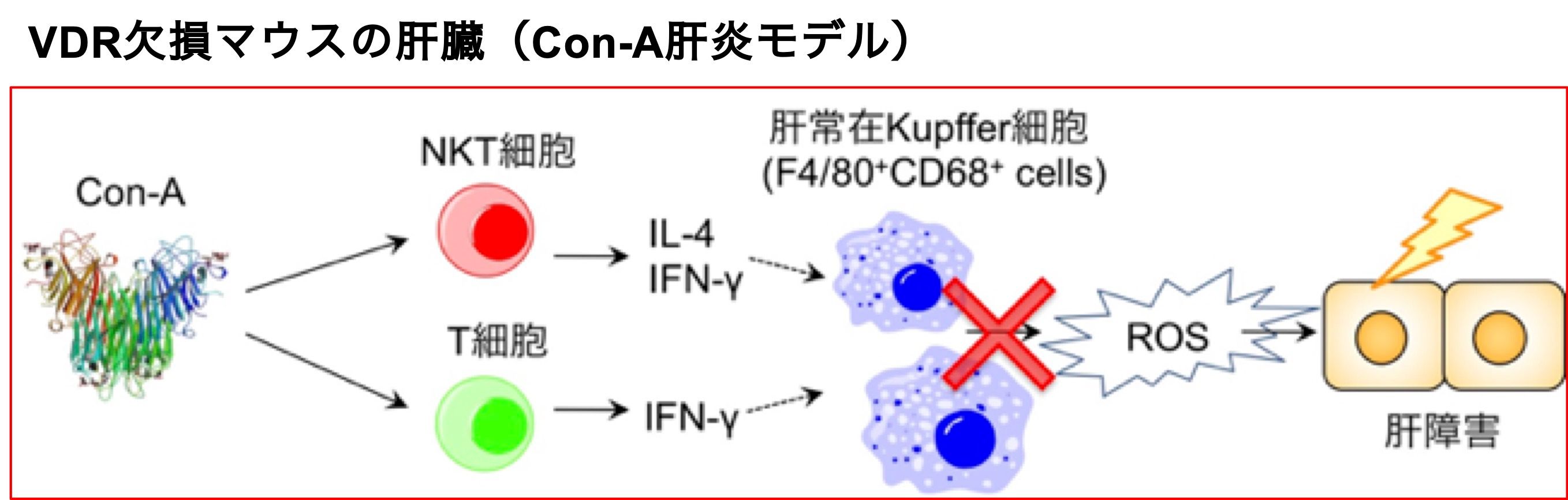
- VDR欠損マウスにおいてKupffer細胞によるROS産生障害により自己免疫性肝炎が減弱する。(Umeda et al., J Leukoc Biol, 2019)。
非SUMO化PPARγ
PPARγは脂肪酸の受容体で、脂肪酸が結合することで活性化しますが、その一方SUMO化などの翻訳後修飾で活性が低下します。PPARγのSUMO化部位であるLys107をSUMOが結合出来ないArgに置換して非SUMO化PPARγマウスを作成し、それらに高脂肪食を付加して耐糖能や脂肪組織の遺伝子発現の解析を行いました。その結果、非SUMO化PPARγマウスは野生型と比べ高脂肪食付加後も高い耐糖能を保持し、また脂肪組織においてエネルギー代謝に関連する遺伝子発現が上昇、炎症関連遺伝子が低下していることを見出しました (Katafuchi et al. Proc Natl Acad Sci USA 2018)。
FGF15及びC型ナトリウム利尿ペプチド(CNP )
FGF15: 胆汁酸分泌をコントロールするホルモン
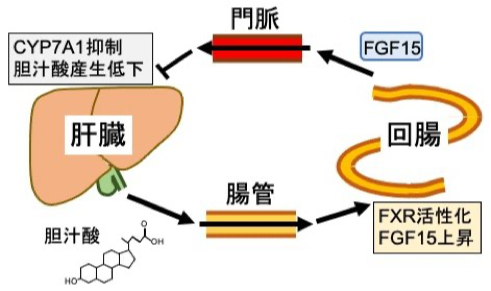
FGF15は回腸から分泌されるげっ歯類のホルモンで、ヒトではFGF19と呼ばれています。このホルモンは胆汁酸の刺激により産生が上昇し、それには胆汁酸の受容体であるFXRを介していることが明らかとなっています。FGF15は分泌後に門脈を介して肝臓に発現するFGFR4/β-Klotho受容体複合体を刺激し、胆汁酸合成の律速酵素であるCYP7A1の発現を低下させることがFGF15欠損マウス及びβ-Klotho欠損マウスの解析から明らかになり、FGF15は回腸で胆汁酸を感知して、肝臓の胆汁酸合成抑制の橋渡しを行うフィードバックホルモンであることが証明されました(Katafuchi et al., Cell Metab 2015)。
CNPによる脂肪細胞分化の活性化
脂肪細胞分化メカニズムの解明は、肥満の治療法を開発する上で極めて重要と考えられています。一般に3T3-L1前駆脂肪細胞の脂肪細胞分化が研究モデルとして用いられており、この細胞をインスリン、合成グルココルチコイドであるデキサメタソン、及びホスホジエステラーゼ(cAMPとcGMPを不活化する酵素)の阻害薬であるIBMXを含む分化誘導培地で刺激すると脂肪細胞に分化します。IBMXの代わりに3T3-L1前駆脂肪細胞の細胞内cGMPを上昇させるホルモンであるCNPを含む分化誘導培地で刺激したところ、脂肪細胞分化が強く誘導されることが分かりました(Katafuchi et al. Peptides 2010)。
ダイオキシン受容体
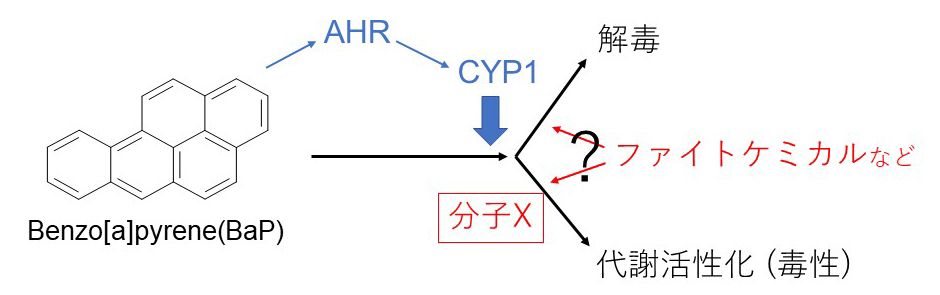
ダイオキシン受容体(AHR)は、核内受容体スーパーファミリーではありませんが、ダイオキシンや喫煙毒性成分であるベンゾ[a]ピレン(BaP)によって活性化し、代謝酵素の遺伝子発現を誘導するいわゆる”核内受容体”です。
BaPがAHRに作用して、CYP1ファミリーの酵素を誘導します。CYP1酵素がBaPをより毒性の強い化合物に代謝し(代謝活性化)、種々の障害を引き起こすと考えれています。しかし、CYP1酵素の遺伝子欠損マウスの解析から、これまで悪者と考えられていたCYP1A1は、むしろBaPの解毒に関与することが明らかになりました(Uno et al., Mol Pharmacol 2004; Uno et al., Mol Pharmacol 2006)。私達は、AHR-CYP1カスケードの疾患の病態における意義や核内受容体スーパーファミリーカスケードとのクロストークの研究を行っています。
- CYP1A1及びCYP1B1はBaPによるAHR活性化を抑制し、CYP1A1及びCYP1A2はBaP依存性のDNA付加体形成を抑制する(Endo et al., Toxicol Appl Pharmacol 2008)。
- AHRの活性化は、VDR依存性のビタミンD不活性化酵素CYP24A1の遺伝子発現を増強する(Matsunawa et al., Toxicol Sci 2009)。
- VDRの活性化は、AHRとともにCYP1A1のプロモーターに相互作用し、CYP1A1遺伝子発現を促進する(Matsunawa et al., Drug Metab Disp 2012)。
- AHRの活性化は、胆汁鬱滞による肝細胞壊死や炎症反応を増悪させるが、CYP1A1は病態を抑制する(Ozeki et al., Toxicology 2011)。
- BaPは動脈硬化を誘導するが、CYP1A1はその病態を抑制する(Uno et al., Toxicology 2014)。
- BaPは非アルコール性脂肪肝を悪化させるが、CYP1A1はその病態を抑制する(Uno et al., Food Chem Toxicol 2018)。
- ニンニク精油成分ジアリルトリスルフィドはBaP依存性のCYP1A1、CYP1B1の発現を亢進し、代謝活性化を増加させた(Uno et al., Anticancer Res 2019)。
- BaPは炎症性腸疾患を抑制する(Adachi et al., Chem Biol Interact 2022)。つまりBaPによる病態の悪化や抑制には組織特異性がある。
転写共役因子ESS(DGCR14)
核内受容体などの転写因子は、他のタンパク質やRNAなどと相互作用することで機能を発揮します。それらは、転写共役因子と呼ばれ、ヒストンの修飾(アセチル化、メチル化、リン酸化)を担う酵素群、染色体構造を変化させるクロマチン構造変換群、RNAポリメラーゼとの相互作用を仲介するメディエーター群などが知られています。
ESS2(DGCR14)は、核内受容体RORγと相互作用する因子として同定されたもので、T細胞の分化維持に関わります(Takada, Mol Cell Biol 2015)。ESS2遺伝子は、DiGeroge症候群などの22q11遺伝子欠損症候群の欠失遺伝子として同定されたものですが、機能は未知でした。これまでの研究で、ESS2の機能を明らかにしました。
- ESS2はクロマチン構造変換因子BAZ1Bやリン酸化酵素RSK2と相互作用して、RORγの転写誘導活性を促進し、T細胞分化を調節する(Takada, Mol Cell Biol 2015)。
- リン酸化酵素RSKの阻害剤は、Th17細胞分化を抑制し、実験的自己免疫性脳炎を抑制する(Takada et al., Immunobiology 2016)。
- ESS2はN末側でRORγ、C末側でスプライソソームと相互作用する。またESS2のノックダウンはRORγとlncRNAの相互作用を低下させる(Takada et al., Biochem Biophys Res Commun 2018)。
- ESS2は、CD4陽性T細胞の胸腺後の機能に必要である(Takada et al., J Biol Chem 2022)。
新たに作出したESS2ノックアウトマウスを用いての機能解析や生体内での役割、RSK阻害薬の免疫抑制作用を解析し、免疫疾患やがんなどとの病態との関連性や治療への応用を目指しています。
肝炎ウイルスとがんなどのオミクス研究
- 江角教授グループがH29年3月まで所属していた病態病理学系形態機能病理学分野での研究を継続しています。
- 参考文献
肝炎ウイルスとがんなどのオミクス研究をしています
疾患オミクスとは、病態の異なる疾患の組織について、遺伝子やタンパク質を対象に網羅的な解析から違いを見出すことです。たとえばDNA配列の比較から変化のある遺伝子を見つけることをゲノミクスと言い、mRNA発現量の比較から差のある遺伝子を見出すことをトランスクリプトミクスと言います。またタンパク質発現の比較から、差のあるタンパク質をみつけだすことをプロテオミクスと言います。疾患の本態を分子レベルで知ったり、分子診断マーカーや分子治療マーカーをみつけだしたりすることに役立てます。
ヒト肝臓組織におけるC型肝炎ウイルスと宿主との攻防
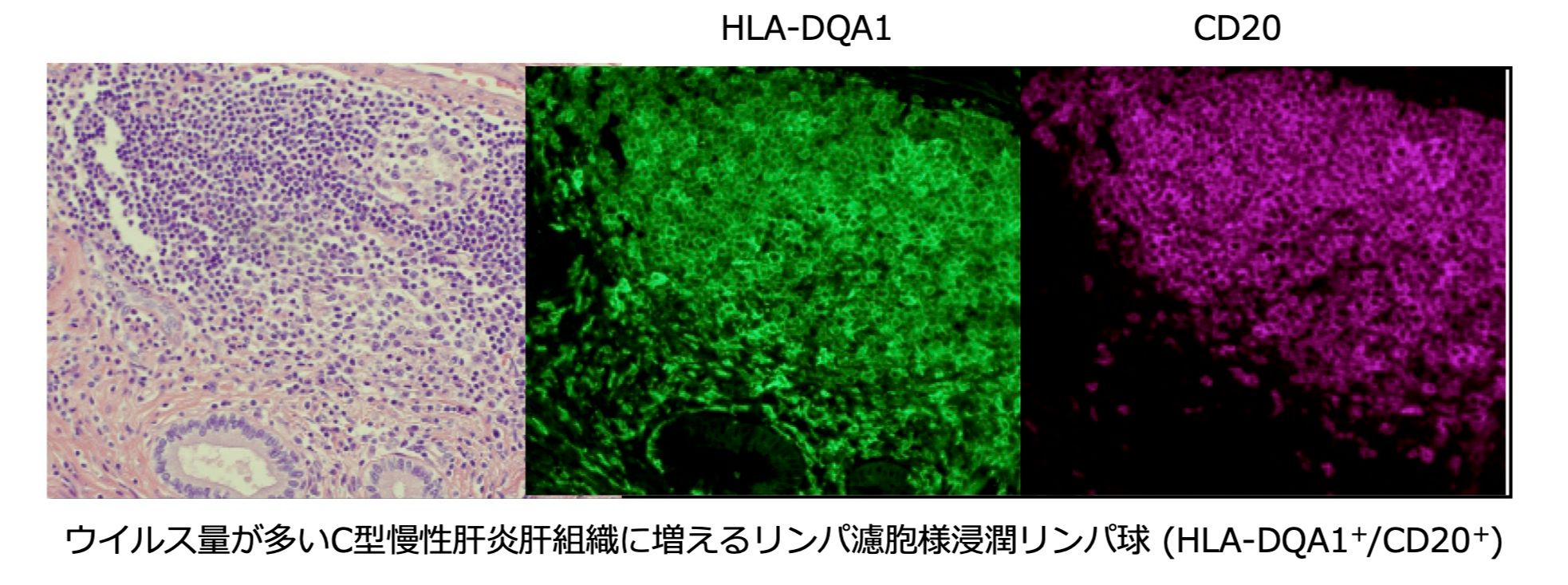
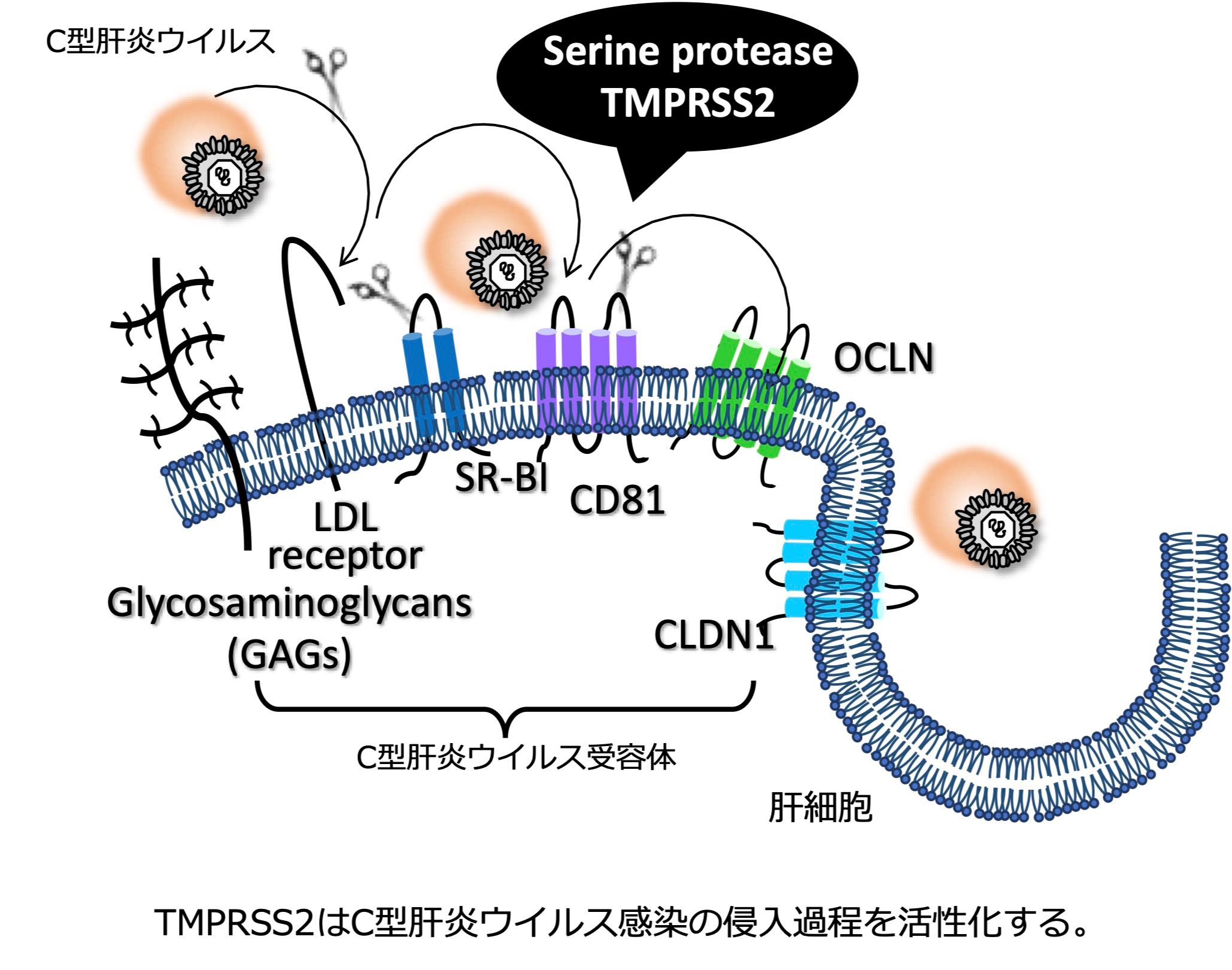
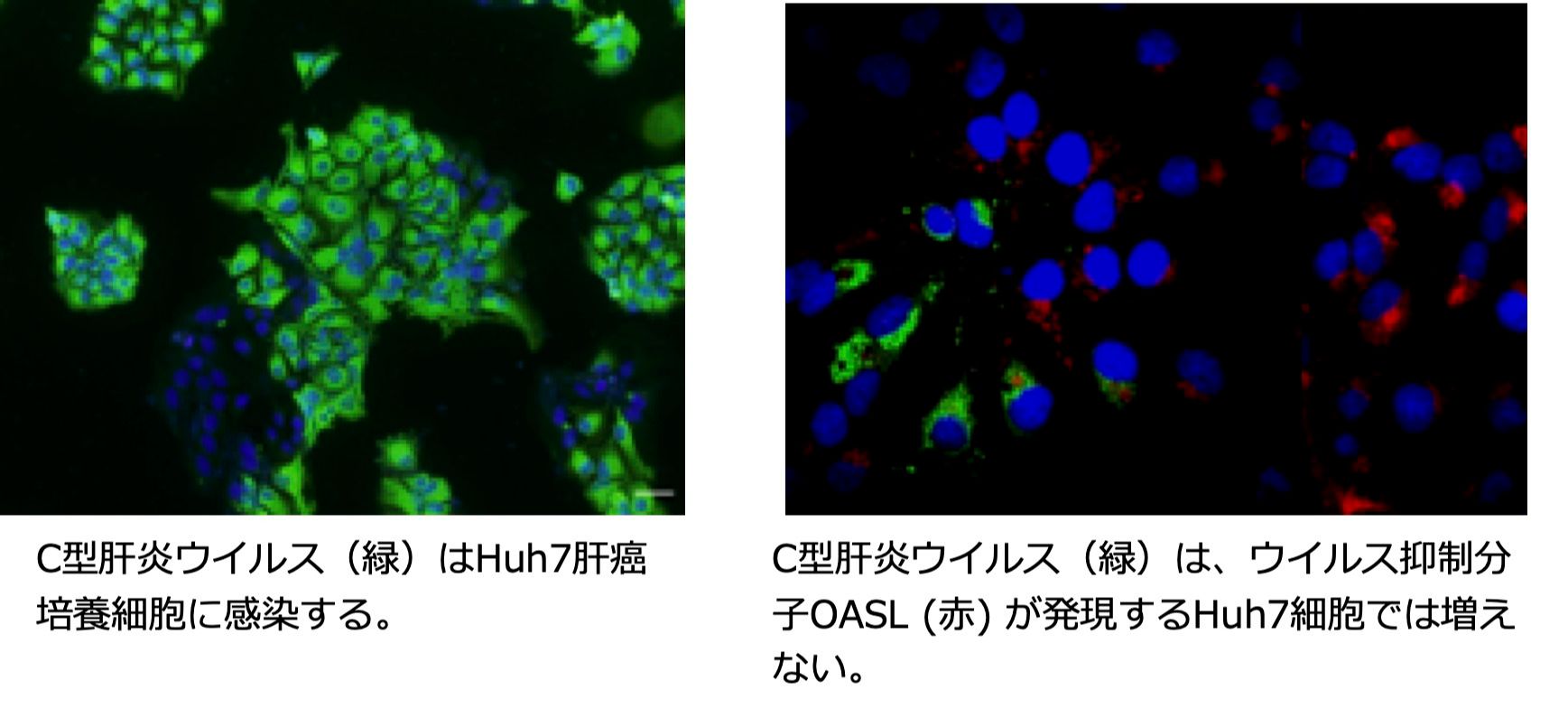
ウイルス量の多い肝臓を少ない肝臓と比べることにより、発現亢進する26個の遺伝子を見つけました(トランスクリプトミクス)。HLA-DQA1は抗原提示細胞の増加を(Ishibashi et al., Arch Virol 2018)、OASLはウイルス複製抑制能を有することがわかりました(Ishibashi et al., Biochem Biophys Res Commun 2010)。細胞膜セリンプロテアーゼTMPRSS2は、ウイルス感染を活性化することもわかりました(Esumi et al., Hepatology 2015)。この他、肝臓類洞内皮細胞に特異的に発現するC型レクチンCLEC4Mは、ウイルスをキャッチして感受性細胞に受け渡すトランスインフェクション機能のあることがわかりました(Ishibashi et al., Arch Virol 2014)。
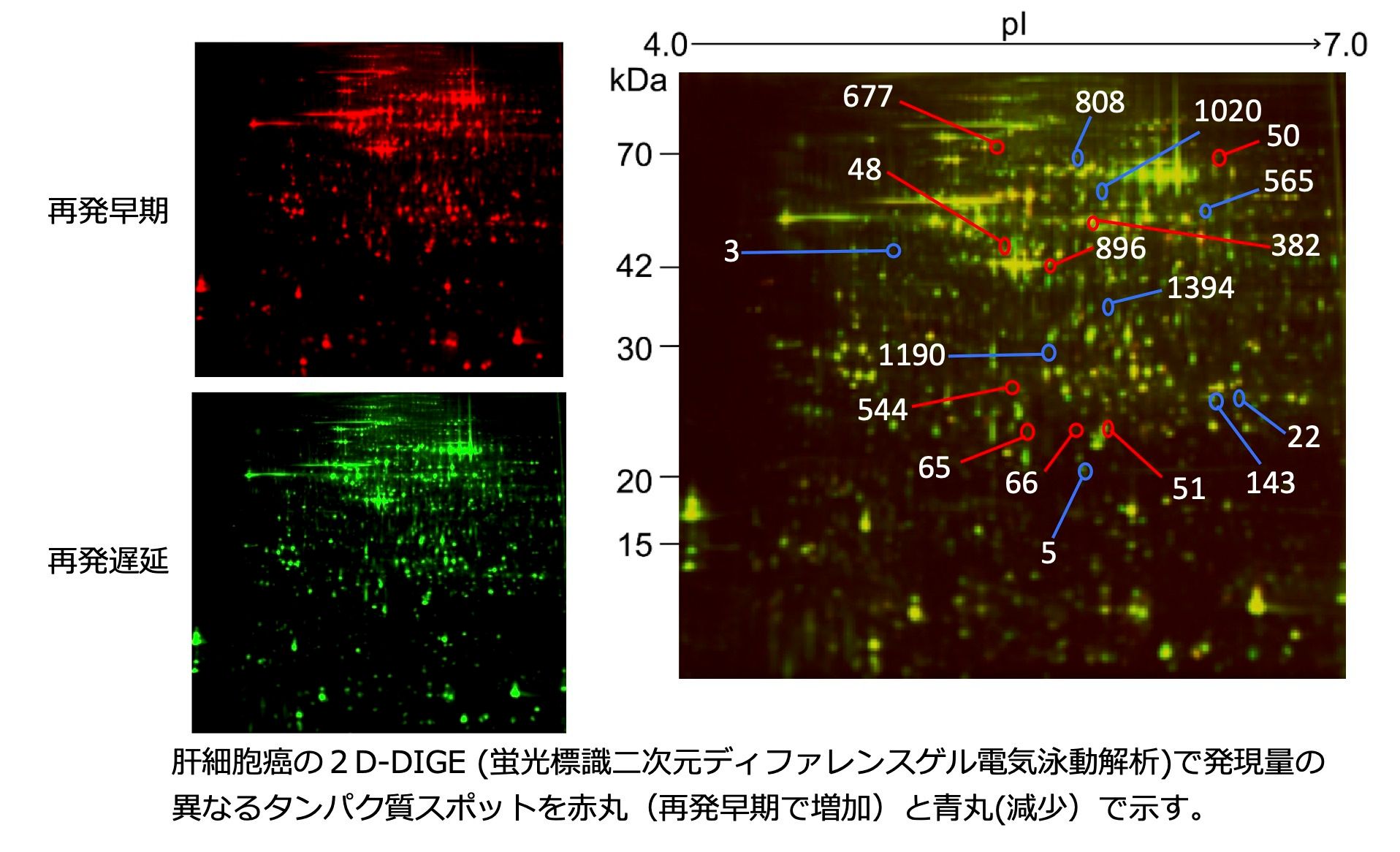
ヒト肝細胞癌再発マーカーの癌部からと非癌部からの探索
肝細胞癌の再発には、初発の癌の肝内転移と初発の癌とは異なる多中心性発癌と があります。肝内転移しやすい癌の特徴的タンパク質発現を、プロテオーム解析から見つけました(Yamaguchi et al., Int J Oncol 2017)。多中心性発癌しやすい非癌部のmRNAの microarray解析(トランスクリプトミクス)やタンパク質2次元ゲル電気泳動解析(プロテオミクス)から,間質由来の遺伝子やタンパク質ーすなわち微小環境因子ーが再発と深く関わることがわかってきました。
レーザーキャプチャーマイクロダイセクションを用いた疾患オミクス
レーザーキャプチャーマイクロダイセクションを用いて、顕微鏡下で特徴的な細胞集団、組織領域をくり抜いて、タンパク質発現変化や遺伝子変異を網羅的に検索し,局所におこる分子レベルの変化を明らかにしています。これらをミクロプロテオミクス、ミクロゲノミクスと呼び、主には病理診断に用いられるホルマリン固定パラフィン包埋組織から実施し,将来,新たな分子診断,分子治療につながることを期待しています。たとえば
- ヒト肝臓組織におけるC型肝炎ウイルス制御因子として、門脈域周囲の肝実質細胞に発現増強するタンパク質をLC/MS解析で見つけました。その遺伝子編集培養細胞では、ウイルス感染が増強、逆に発現増強細胞ではウイルス感染が抑制されました。
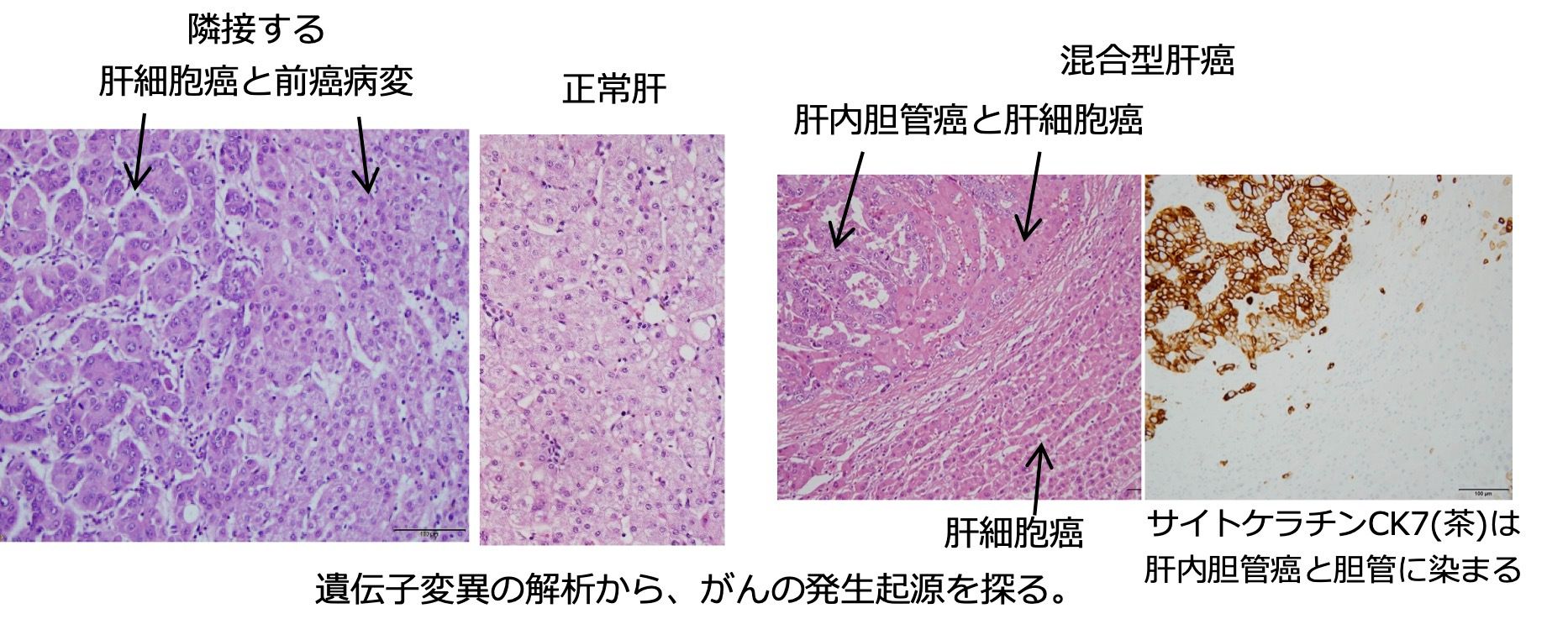
- 癌の発生進展におけるゲノム遺伝子変異の進化とドライバー変異について、同一症例内に見られる複数箇所の癌組織および前癌病変、増殖性病変などを検討すると、がんの進展方向や発生起点、それらの決め手となる遺伝子変異が明らかとなってきました。ヒト早期肝細胞癌と前癌病変、乳管癌小葉癌併存型乳癌(Kobayashi et al., Mol Med Rep 2021)、舌癌と前癌病変などを例にして、がんの分子進化研究を進めています。またラット肝細胞癌の肝内転移、肺転移についても、同様の解析を進めています。最近、ヒト混合型肝癌の肝内胆管癌は、先に発生した肝細胞癌から分化転換(transdifferentiation)することをみつけました(Ohni et al., Oncol Lett 2022)。また、3年ごとに繰り返し発生したヒト異時性多重肝細胞癌では、多中心性発癌と肝内転移が順次起こっていることが示されました(Ohni et al., Oncol Lett 2022)。さらに、ヒト肝細胞癌のドライバー変異のひとつ、テロメラーゼ逆転写酵素遺伝子(TERT)プロモーター変異が、肝硬変になっていない慢性肝炎非癌部組織にも既に起こっていることを見つけました(Ohni et al., Oncol Lett 2022)。この間、これらの解析に使用するホルマリン固定パラフィン包埋組織の固定法やDNA抽出法の限界と改良点を明らかにしました(Einaga et al., PLoS ONE 2017)。それに伴い、次世代シーケンシング解析にも問題無く利用できる、新たなDNA定量法を提示しました(Nakayama et al., PLoS ONE 2016)。
腰椎椎間板変性のオミクス
腰痛の原因のひとつに、椎間板変性があげられます。その危険因子の一つに喫煙が知られています。その因果関係や、変性機序および病態について、個体レベルでの分子解明はなかなか進んでいません。そこでオミクス研究から、まずは病態を分子変化で捉えてみました。
- 受動喫煙ラットでは椎間板変性が起こります。そのモデルラットで、椎間板の軟骨細胞がアポトーシスをおこし、細胞外マトリックスを構成するタンパク質が減ってしまうことを見いだしました(Nakahashi et al., PLoS ONE 2019)。また時計遺伝子のサーカディアンリズムが6時間シフトすることがわかりました(トランスクリプトミクス)(Numaguchi et al., J Orthop Res 2016)。
- ヒト腰椎椎間板変性も加齢と共に観察されます。同一個体でも椎間板の場所によって変性しやすい場所があります。その様々な変性箇所をレーザーキャプチャーマイクロダイセクションで採取し、タンパク質のLC/MS解析を使って、変性に伴って変化するタンパク質をみつけています(プロテオミクス)。
頭頸部癌、腎細胞癌のオミクス
- 遺伝病von Hippel-Lindau 病の原因遺伝子VHLは、がん抑制遺伝子としても知られています。VHL遺伝子の欠失を直接高感度に検出する方法を開発しました(Mochida et al., J Urol 2008)。腎細胞癌にはVHL遺伝子欠失と点突然変異が両側性に起こる2ヒットだけで無く、片側欠失または片側変異の1ヒットの癌も4割近くありました(Hamano et al., J Urol 2002; Igarashi et al., Cancer 2002)、舌癌にも高頻度にVHL遺伝子欠失が起こっていることを見つけました(Asakawa et al., Cancer 2008)。VHLタンパク質を病理診断用組織切片で検出できるように免疫染色法を開発したところ、不思議なことに、VHLタンパク質は舌癌部分および前癌病変部分によく発現していることがわかりました(Hasegawa et al., BMC Cancer 2017)。前癌病変マーカーとしての有用性を検討しています。
- 上咽頭癌は、シスプラチン・放射線の併用療法が行われます。が、しばしば治療抵抗性を示すことがあり、その機序についてはよくわかっていません。シスプラチン治療抵抗性予測因子として、がん抑制遺伝子TP53変異を見つけました(Kudo et al., Oncol Rep 2010)。このTP53変異癌の遺伝子発現の特徴をトランスクリプトミクスから解析したところ、不思議なことに癌の進展、悪性化とは逆の形質を示していました。またTP53変異癌では、p53タンパク質の核局在が癌全体に均一で無く、癌周縁部の癌細胞にのみ見られるという癌細胞の多様性が認められました(Kudo et al., Oncol Lett 2017)。
その他の研究については、業績一覧をご参照下さい。