研究の概要 Ca2+シグナルの基本機構から生体機能を探る
カルシウム(Ca2+)シグナルは普遍的で基本的な細胞内情報伝達機構です。私達はこれまでに、Ca2+シグナルの多機能性を担う多様な時空間動態の形成基盤を明らかにしてきました。この研究成果を基盤とし、分子・細胞・組織・個体レベルでの生体機能の理解に取り組んでいます。
1.これまでの研究の流れ
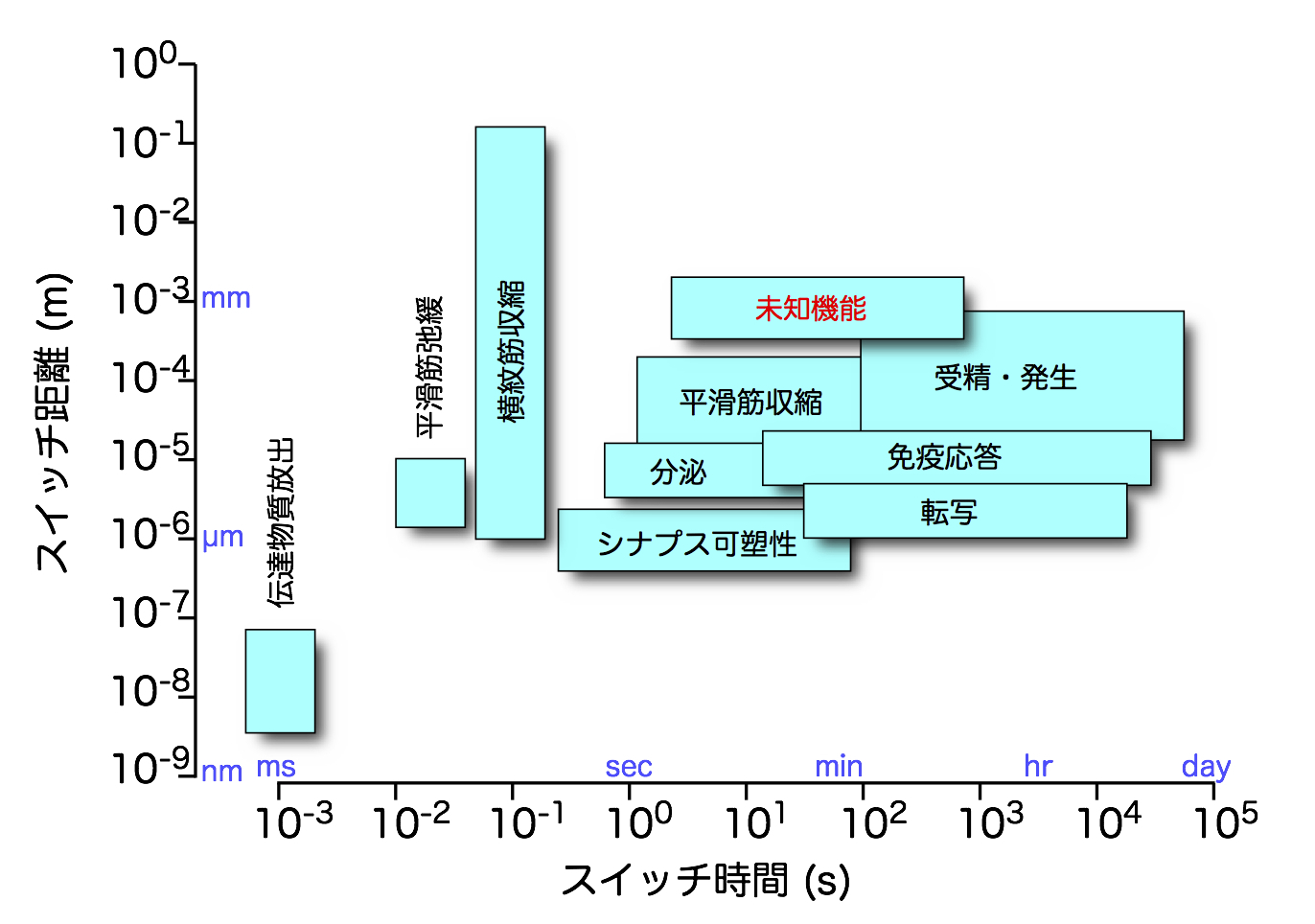
細胞内Ca2+シグナルは、主要な生理機構には必ずといっていいほど関与する極めて重要なシグナル機構です。いくつか例を挙げてみましょう。まず、生命誕生の発端である受精に際して卵細胞内でCa2+シグナルが形成されます。さらに、発生にもCa2+シグナルは重要であることが示されています。骨格筋の収縮を制御して、私達が自由に運動できるようにしているのはCa2+シグナルです。また、一時も休み無く、血液を送り続ける心臓では、拍動ごとにCa2+シグナルが働いていますし、血管平滑筋細胞のCa2+シグナルによって血圧が制御されます。ホルモンや消化液などの分泌をコントロールしているのもCa2+シグナルです。さらに、免疫系でも重要な働きをしており、リンパ球のCa2+シグナルが異常になると免疫不全になることが知られています。中枢神経系でも、Ca2+シグナルは重要な役割を果たしています。神経伝達物質の放出に必須なことに加えて、シナプス可塑性に関与しています。シナプス可塑性は記憶や学習の素過程とされていますので、Ca2+シグナルなしでは、私たちの脳は環境に順応できず新たな知的創造を行うこともできないわけです。このように、Ca2+シグナルは、ミリ秒から時間、日という幅広い時間単位の様々なかつ重要な生体機能の制御に関わっています。また、様々な病態に関与していることも知られています。さらに、Ca2+シグナルが制御している機能は、実は未知のまま多数残されています(図1)。
Ca2+という単純な分子が、このように多様で、しかも重要な機能を制御できるというのは、驚嘆に値します。私達は、Ca2+制御機構の解明を通じて、細胞機能制御機構の本質に迫る研究を続けてきました。
2.Ca2+シグナルの基本機構研究
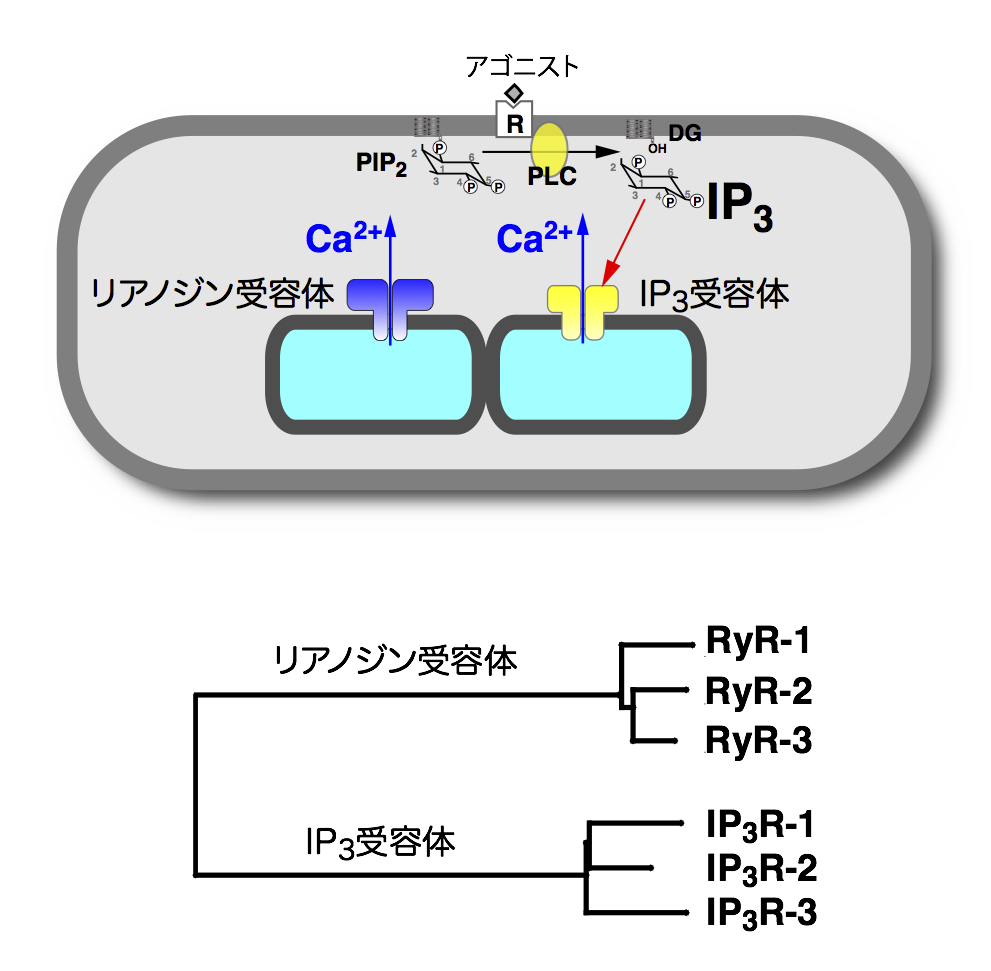
細胞内Ca2+シグナルは、細胞膜に存在するCa2+チャネルを介して細胞外から細胞内へのCa2+の流入と、細胞内Ca2+ストア(小胞体)からCa2+放出チャネルを介して細胞質への放出による2通りの経路により作られます。Ca2+放出チャネルには、イノシトール三リン酸(IP3)受容体(IP3R)と、リアノジン受容体(RyR)という2種類の分子が関与しています。IP3RもRyRもほ乳類ではそれぞれ3種の遺伝子によりコードされていますが、相同な遺伝子であり、一つの遺伝子が2通りに進化してきたものと考えられています(図2)。
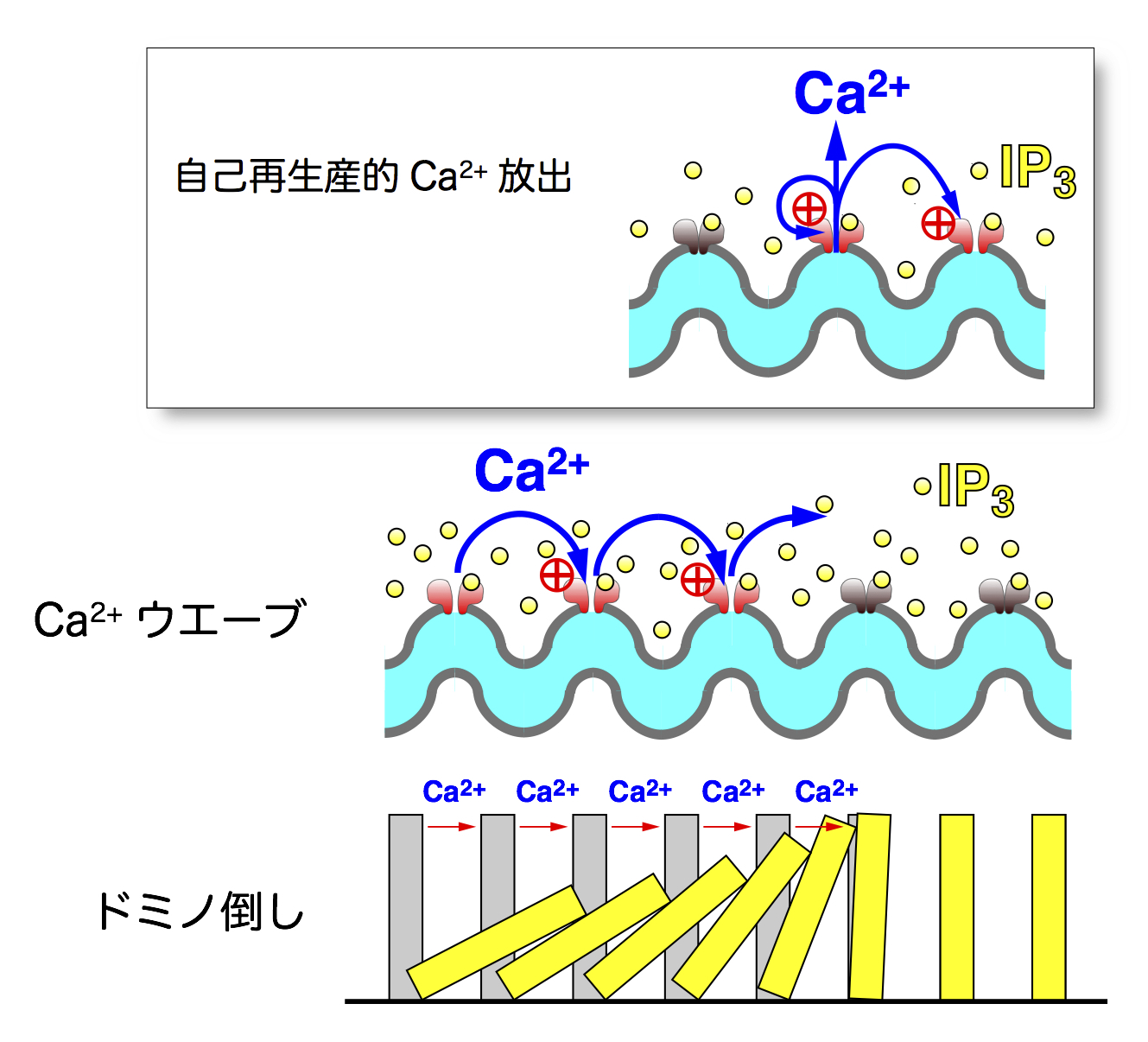
私たちは、これらCa2+放出チャネルの基本メカニズムについて研究を開始しました。まず、IP3受容体の活性化には、IP3だけでは不十分で、同時にCa2+が必要である事を明らかにしました。これは、IP3受容体を介したCa2+放出がIP3受容体をさらに活性化するというポジティブ・フィードバック制御機構があり、自己再生産的なCa2+放出が起こることを示しています。細胞内Ca2+動態のイメージング(可視化)によると、細胞内Ca2+濃度は細胞内の一部から上昇が始まりこれが順次細胞全体に伝わる「Ca2+ウエーブ」と呼ばれる現象が知られています。なぜこのようなCa2+ウエーブが見られるか、様々な想像が行われていましたが、私たちが発見した自己再生産的なCa2+放出機構により、ドミノ倒しと相同のメカニズムでCa2+ウエーブが発生すると理解できるようになりました。このように、自己再生産的Ca2+放出機構は、Ca2+シグナルの細胞内動態を考える上で必要不可欠な研究成果として、Ca2+シグナル研究に大きな影響を与えています(図3)。また、RyRについては3種全ての遺伝子をそれぞれノックアウトして、生体における機能を解析するとともに、後述するように一酸化窒素シグナルとの連関機構を明らかにして生理および病態生理的意義を同定しました。
Ca2+ウエーブの発見に見られるように、Ca2+シグナル研究は「蛍光Ca2+インジケーター」の発達により、可視化研究が最も先に進展した領域です。Ca2+シグナルのイメージングは、最初は単離細胞や培養細胞でのみ行われていましたが、私達は生きた組織の中の個々の細胞内Ca2+シグナルをイメージングする事に初めて成功しました。これにより、単離細胞におけるアーチファクトではないかと疑われる事も多かった「Ca2+オシレーション」(細胞内Ca2+濃度の振動現象)が、生理的な現象である事がはっきりしました。
Ca2+オシレーションがどのようなメカニズムで起こるのかについても、様々な憶測が行われていました。IP3受容体には3種のサブタイプがあり、性質が少しずつ異なりますが、サブタイプ毎に違ったパターンのCa2+オシレーションを起こすことを私達は発見しました。さらに、IP3受容体上のCa2+センサー領域を同定することにも成功しており、この領域に変異を導入してIP3受容体のCa2+感受性を低下させると、Ca2+オシレーションが抑制されることを実験的に示し、自己再生産的なCa2+放出機構がCa2+オシレーション形成に重要であることを明確にしました。
一方、Ca2+オシレーションによってコードされる情報を、細胞がどのように解釈するのかという基本的な問題があります。私達は、Ca2+依存性に脱リン酸化されると核内に移行してIL-2などの転写を制御するNuclear Factor of Activated T cells(NFAT)について、細胞内局在とCa2+シグナルの関係を解析しました。この結果、脱リン酸化NFATはCa2+シグナルの作業記憶素子(平均寿命7分間)として機能することを明らかにしました。従って、Ca2+オシレーション頻度が増加するとともに、シグナル作業記憶素子である脱リン酸化NFATが細胞質に蓄積し核内移行が促進されます。このような分子的な記憶素子を用いたメカニズムによって、Ca2+オシレーション頻度のデコーディングが行われることを私達は明らかにしました。さらに、この研究により、Ca2+オシレーションは、細胞の負担を減らして効率よく機能を制御する方法であることも明らかになりました。
- Iino, M. J. Gen. Physiol. 94, 363–383, 1989.
- Iino, M. J. Gen. Physiol. 95, 1103–1122, 1990.
- Iino, M. J. Gen. Physiol. 98, 681–698, 1991.
- Iino, M. & Endo, M. Nature 360, 76–78, 1992.
- Hirose, K. & Iino, M. Nature 372, 791–794, 1994.
- Takeshima, H. et al. Nature 369, 556–559, 1994.
- Takeshima, H. et al. EMBO J. 14, 2999–3006, 1995.
- Takeshima, H. et al. J. Biol. Chem. 271, 19649–19652, 1996.
- Yamazawa, T. et al. EMBO J. 15, 6172–6177, 1996.
- Takeshima, H. et al. EMBO J. 17, 3309–3316, 1998.
- Miyakawa, T. et al. EMBO J. 18, 1303–1308, 1999.
- Tomida, T. et al. EMBO J. 22, 3825–3832, 2003.
3.Ca2+および関連シグナルの可視化研究
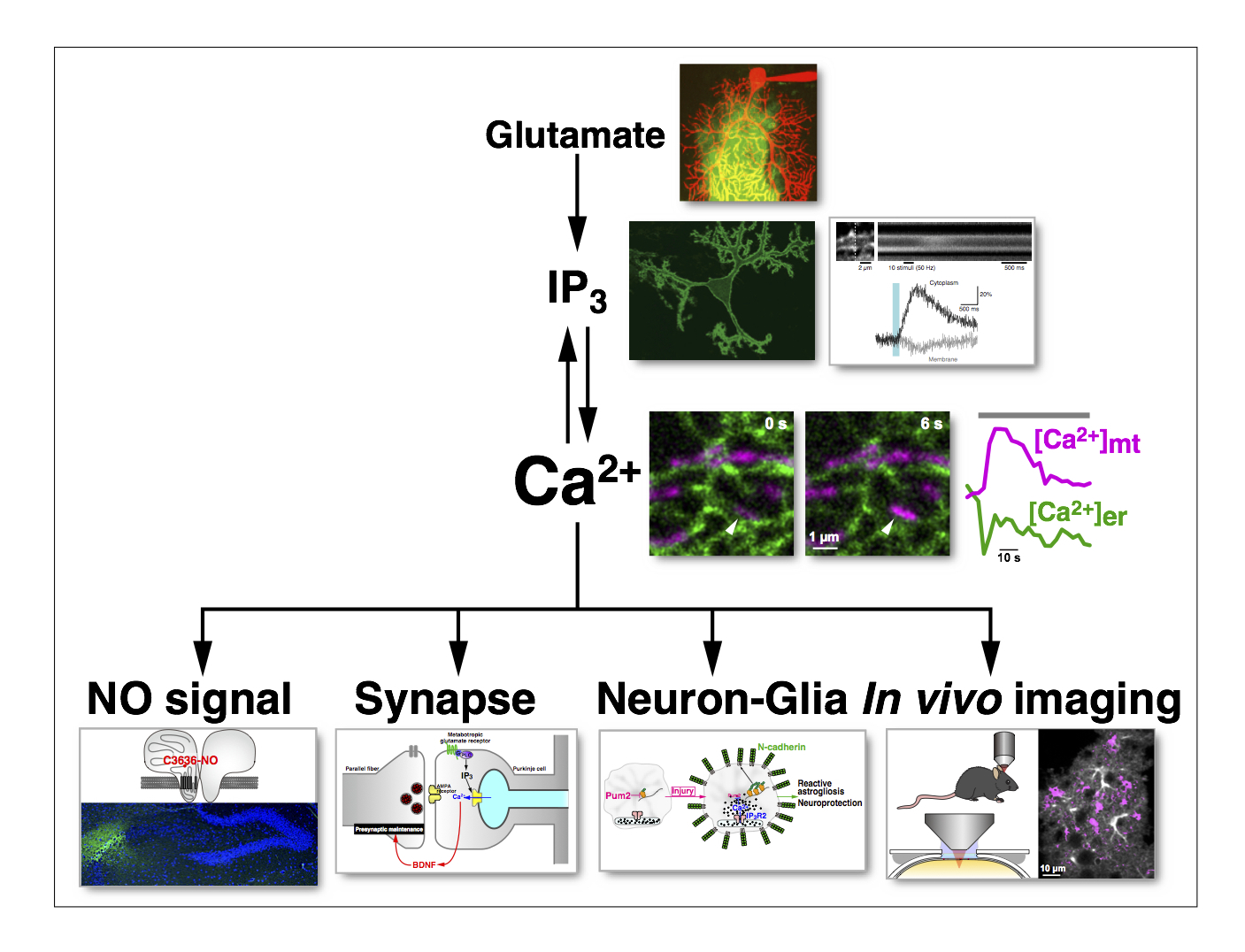
以上の通り、Ca2+シグナルと一口に言っても、Ca2+ウエーブやオシレーションと言った時間的・空間的パターンでその細胞内シグナルとしての意味がコードされることが分ってきました。それでは、シグナルの意義が、時間的・空間的パターンに依存するということは、Ca2+シグナルに限った特殊なことでしょうか?そうとは言いきれません。そこで、私たちはCa2+以外のシグナル分子についても新たな可視化プローブを作製して時空間動態を解析し、生体機能制御機構を研究してきました(図4)。
IP3の可視化
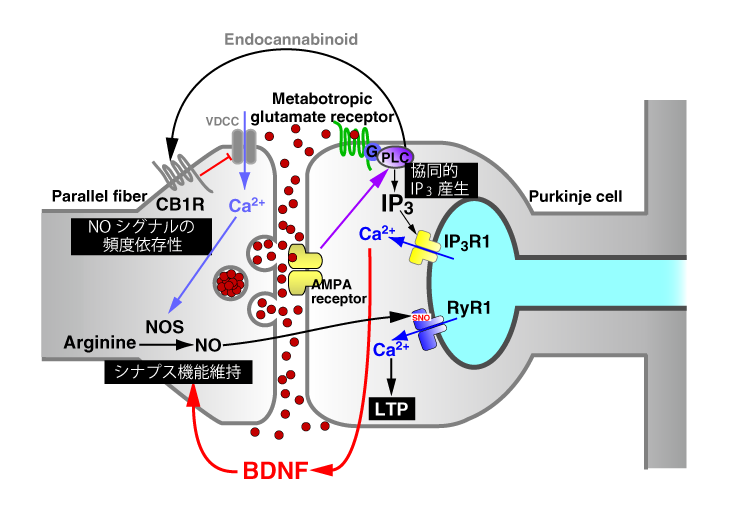
まず、私達はCa2+シグナルの上流にあるIP3動態の可視化に成功しました(GFP-PHD)。驚くべきことに、IP3濃度も細胞内でダイナミックに変動し、「IP3ウエーブ」や「IP3オシレーション」が見られることを発見しています。さらに、この方法を神経細胞に応用して、細胞膜の脱分極に伴う新しいIP3シグナル機構を発見しました。また、シナプス入力に伴うIP3シグナルを可視化し、従来考えられていたように代謝型グルタミン酸受容体だけでなく、イオンチャネル型グルタミン酸受容体もIP3シグナル形成に関与することを示しました(図5)。
- Hirose, K. et al. Science 284, 1527–1530, 1999.
- Okubo, Y. et al. Neuron 32, 113–122, 2001.
- Okubo, Y. et al. J. Neurosci. 24, 9513–9520, 2004.
NOの可視化
続いて、一酸化窒素(NO)の可視化のためのインジケーター(HBR-GFP)を可溶性グアニル酸シクラーゼのヘム結合部位を基本として新たに開発しました。これにより、小脳において、平行線維からプルキンエ細胞へのシナプス入力に伴うNOシグナルの可視化という画期的な実験に成功しました。この結果により、NOシグナルは従来考えられていたような広範囲に広がるシグナル分子ではなく、シナプス近傍に限局したシグナルになり得るということが判明しました。さらに、NOシグナルは、平行線維の刺激周波数に二相性に依存する(つまり、NO産生に至適な刺激周波数がある)と言う思いがけない結果が明らかになりました。また、このNOシグナルは、平行線維→プルキンエ細胞シナプスの長期増強(LTP)を惹起し、LTPもやはり平行線維入力周波数に二相性に依存することが明らかになりました(図5)。
- Namiki, S. et al. J. Physiol., 566, 849–863, 2005.
PYK2の可視化
PYK2はFAK (Focal Adhesion Kinase)ファミリー分子で、Ca2+依存性のチロシンリン酸化酵素です。シナプス可塑性との関連も示唆されている事から、PYK2を可視化したところ、細胞境界の接着焦点に局在して細胞を後退させる事が分りました。この際に同時にCa2+シグナルも必要な事が分り、それを探索したところ、細胞間の接触面に限局する自発的Ca2+シグナル(Ca2+ライトニング、Ca2+雷光)を発見しました。これは、細胞間の接触を感知するメカニズムと考えられます。
- Hashido, M. et al. EMBO Rep. 7, 1117–1123, 2006.
グルタミン酸シグナルの可視化
グルタミン酸は、中枢神経系における最も重要な伝達物質です。私達は、グルタミン酸動態を可視化できるインジケーター(EOS)を開発しました。これを用い、シナプスから放出されるグルタミン酸動態の可視化に取り組みました。これにより、平行線維→プルキンエ細胞シナプスでは、バースト刺激に伴いグルタミン酸がシナプス間隙から漏れ出すことの可視化に初めて成功しました(図5)。
- Namiki, S. et al. Eur. J. Neurosci. 25, 2249–2259, 2007.
- Okubo, Y. et al. Proc. Nat. Acad. Sci. U.S.A. 107, 6526–6531, 2010.
細胞内小器官内腔Ca2+濃度の可視化
Ca2+シグナル形成には、小胞体からのCa2+放出が重要であることから、小胞体内腔のCa2+濃度を可視化することは重要な情報となります。しかし、小胞体内腔のCa2+濃度は細胞質に比べて数千倍高く、精度良く測定することは困難でした。私たちは、タンパク質型細胞質Ca2+インジケーターをベースにして、小胞体内腔のCa2+測定に最適化されたインジケーター(CEPIA)を開発しました。また、ミトコンドリアもCa2+シグナル形成に重要な役割を果たすことが知られているので、ミトコンドリア内腔のCa2+インジケーターも開発しました。現在までに、細胞質、小胞体、ミトコンドリアの3画分について蛍光波長の異なるインジケーターが利用可能となっており、3分画の同時Ca2+測定も可能となりました。小胞体内腔Ca2+イメージングを、神経細胞に応用して、シナプス入力に伴う小胞体内腔のCa2+動態の観測に成功し、小胞体が細胞内Ca2+のパイプラインの様に振る舞うとともに、シナプス入力に伴い細胞外から流入したCa2+が小胞体に蓄積され、シナプス入力頻度のメモリーとして機能することを明らかにしています。
- Ishii, K., et al. EMBO Rep. 7, 390–396, 2006.
- Suzuki, J. et al. Nat. Commun. 5:4153, 2014.
- Okubo, Y. et al. J. Neurosci. 35, 15837–15846, 2015.
4.Ca2+シグナルの未知機能探索
先に述べたように、Ca2+シグナルが制御する未知細胞機能はまだ多数残されています(図1)。私たちは、この未知機能を明らかにし、Ca2+シグナル研究の地平を拡大したいと考え、研究を進めてきました。その結果、以下の成果を得て、Ca2+シグナルの様々な生理および病態生理学的意義を明らかにすることができました。
1.シナプス維持機構
小脳の平行線維→プルキンエ細胞シナプスにおいて、プルキンエ細胞のIP3-Ca2+シグナルが、BDNFを介してシナプス機能を維持している事を明らかにしました(図5)。これは、シナプスを使用し続ける事がシナプス機能維持に重要である事を示しています。別の見方をすれば、「使わないシナプスは弱くなる」と言えます。
2.シナプス可塑性と神経細胞死
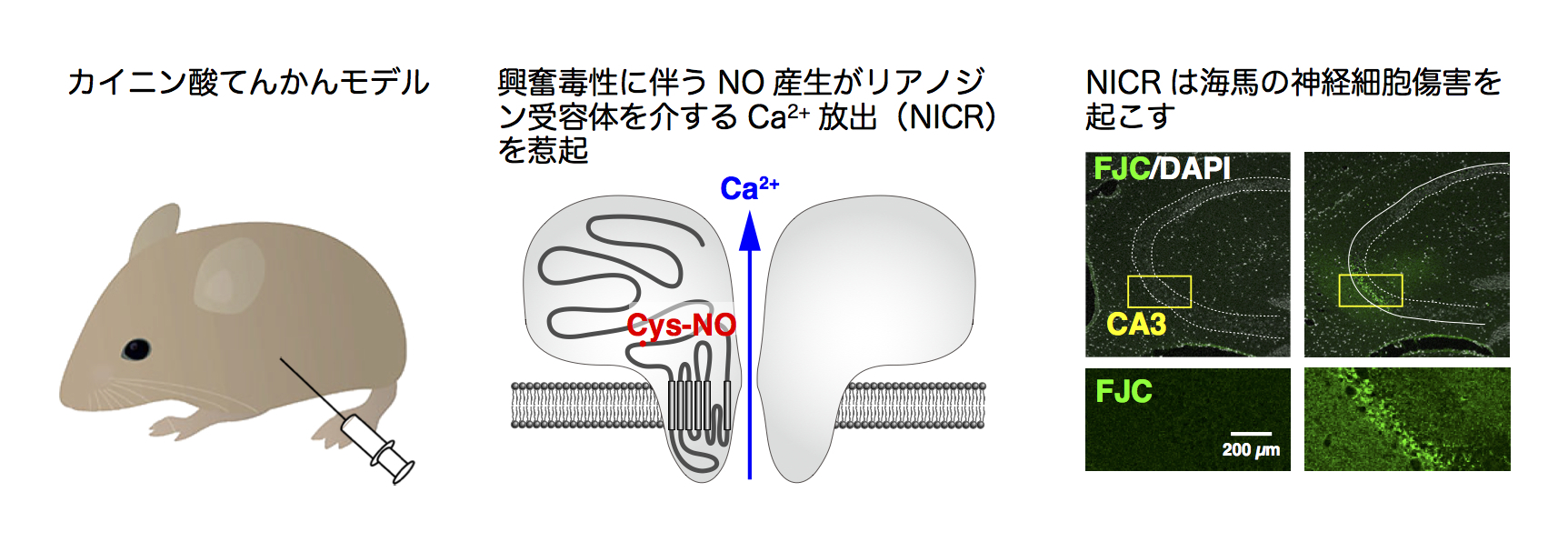
可視化に成功したNOシグナルの意義を追求する研究の過程で、プルキンエ細胞の細胞内Ca2+ストアに存在するリアノジン受容体1型(RyR1)を活性化してCa2+放出を起こすことを明らかにしました。私達は、これをNO-induced Ca2+ release (NICR) 機構と呼び、平行線維→プルキンエ細胞の長期増強(シナプス可塑性)に関与することも明らかにしました(図5)。
また、NICR機構は、てんかんなどに伴う興奮毒性(Excitotoxicity)にも関与するとみられ、神経細胞傷害を惹起することを私たちは明らかにしました(図6)。
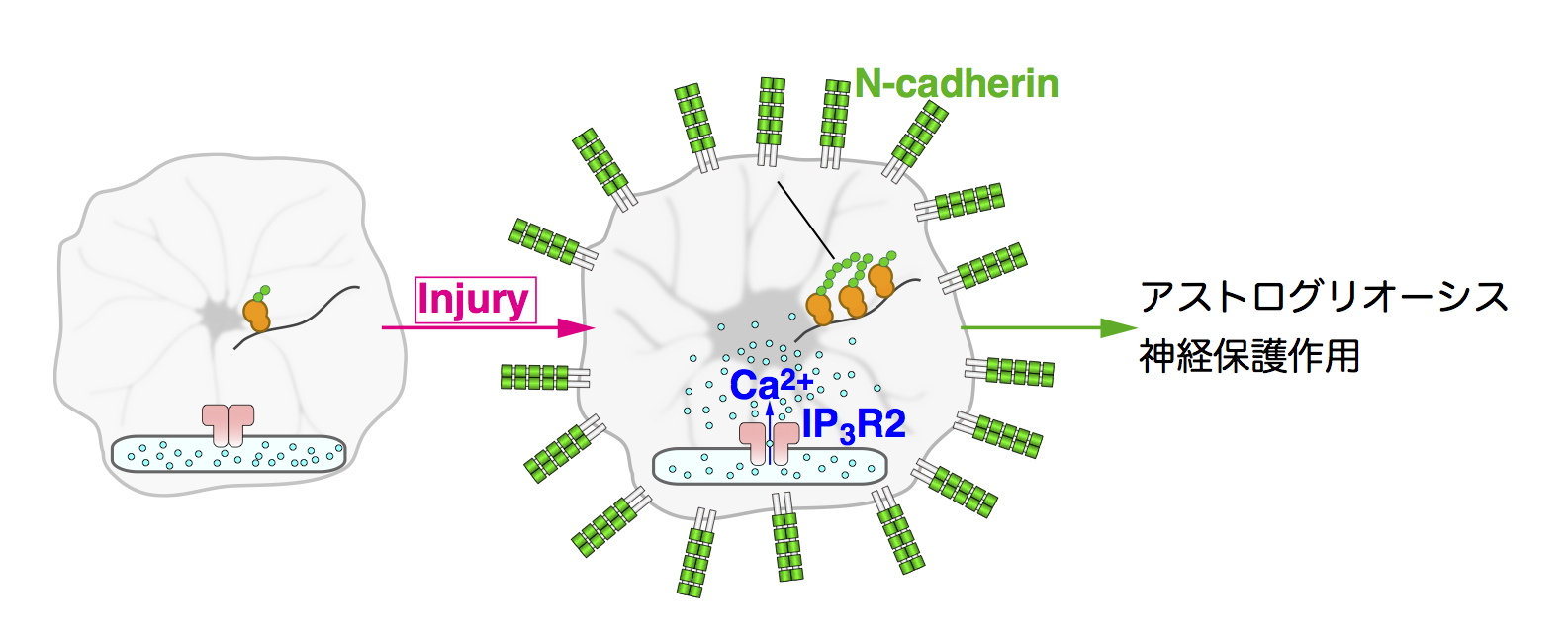
3.アストログリオーシスと神経保護作用
アストロサイトにおける自発Ca2+オシレーションが、アストロサイト表面でN-cadherinの発現レベルを調節する事により、神経突起伸長を制御する事も明らかにしました。さらに研究を進めて、分子機構を同定し、生体内での意義を追究しました。これにより、脳に対する機械的な障害に伴い、アストロサイトでCa2+濃度が上昇し、転写抑制因子Pum-2のダウンレギュレーションがN-cadherinの発現上昇を介して、活性化アストログリオーシスと神経保護作用が生じることを明らかにしました(図7)。
4.トランスポーター発現
小脳バーグマングリアにおけるCa2+シグナル機構は、グルタミン酸トランスポーターの発現レベルを調整して、小脳におけるグルタミン酸クリアランスを制御することを明らかにしました。
5.髄鞘形成
軸索の活動に伴う、細胞外ATPシグナルを介したシュワン細胞内Ca2+シグナルが、髄鞘形成に必要なミトコンドリア機能を制御することを示しました。
- Furutani, K. et al. Proc. Nat. Acad. Sci. U.S.A. 103, 8528–8533, 2006.
- Kanemaru, K. et al. J. Neurosci. 27, 8957–8966, 2007.
- Mashimo, M. et al. Eur. J. Neurosci. 32, 1668–1677, 2010.
- Kakizawa, S. et al. EMBO J. 31, 417–428, 2012.
- Kanemaru, K. et al. Proc. Nat. Acad. Sci. U.S.A. 110, 11612–11617, 2013.
- Ino, D. et al. Cell Rep. 12, 1951–1959, 2015.
- Mikami, Y. et al. EBioMedicine. 11, 253–261, 2016.
5.組織・個体レベルへの展開
新たな機能制御メカニズムを研究する上で、分子・細胞レベルの解析力は極めて強力であり、必要不可欠です。一方、研究解析が、分子・細胞レベルのみで閉じるのではなく、さらに生体全体へと拡張することも重要だと考えています。そこで私たちは、細胞・組織レベルのイメージング法において様々なイノベーションを達成してきましたが、細胞間のコミュニケーションを維持した状態(組織レベル)でのシグナル伝達を解析するという立場を、積極的に取り入れたいと考えてきました。また、個体レベルの解析も必要だと考えています。このためには、個体レベルにおけるイメージングや分子遺伝学的方法も必要だと考えています。現在までに、生きたままのマウスの脳内で、Ca2+、グルタミン酸、細胞外ATPなどのイメージングを行えるようになっています(図8)。
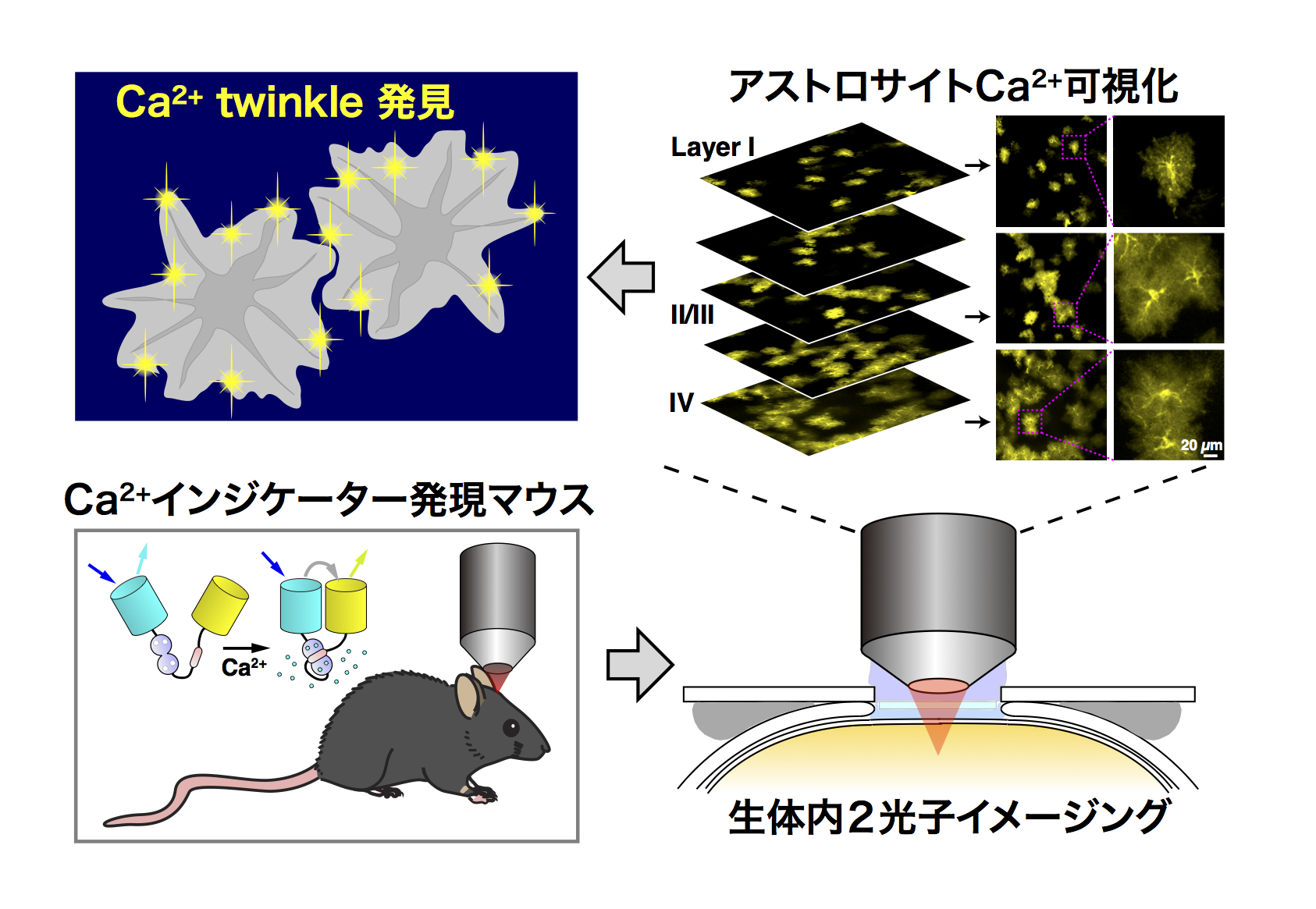
このような、細胞レベルから生体レベルまで統合的なイメージングを行う研究は、脳以外の組織にも適用可能だと考えています。今後の研究では、様々な臓器において統合イメージング解析を展開していきたいと企画しており、なかでも膵内分泌細胞の機能解析を重点的に進めて行きます。
- Okubo, Y. et al. Proc. Nat. Acad. Sci. U.S.A. 107, 6526–6531, 2010.
- Kanemaru, K. et al. Cell Rep. 8, 311–318, 2014.
6.基本的立場
私たちは、複雑なメカニズムを分りやすく目の当たりにできるような、面白い研究を目指しています。また、生命の謎の根幹に迫る、基本的なメカニズムを明らかにしたいと常に考えています。