
我々の研究グループでは、成熟脂肪細胞を体外で脱分化させることにより得られる細胞(脱分化脂肪細胞, Dedifferentiated fat cell: DFAT)が間葉系幹細胞(MSC)と同等の多分化能を有することを明らかにしました(Matsumoto T et al. J Cell Physiol 215:210-222, 2008) 。
現在、この培養技術の開発者である日本大学生物資源科学部動物生体機構学の加野浩一郎准教授のグループとともに、DFATを用いた再生医療の実現を目指した研究を行っています。現在、日本医療研究開発機構(AMED)などから支援を受け、重症下肢虚血をターゲットに、患者年齢や基礎疾患に影響されない実用性の高い再生医療用ドナー細胞として開発を進めています。
また同時に変形性関節症に対する軟骨再生、萎縮性膀胱や腹圧性尿失禁に対する尿道平滑筋再生、重度熱傷に対する皮膚再生などへの適応についても基礎研究を行っています。
さらにDFATが有する免疫制御機構の解析、造血幹細胞移植に伴う生着不全やGVHD予防を目的とした細胞治療法の開発、難治性腸疾患に対する細胞治療の可能性などについても検討を行っています。
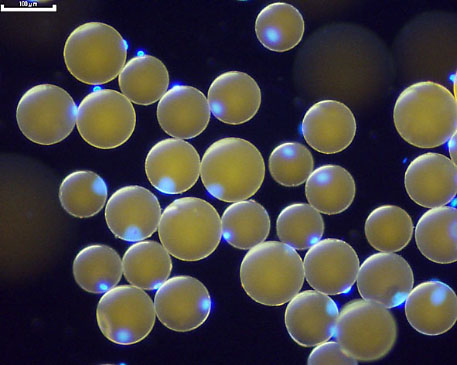
皮下脂肪組織より単離した成熟脂肪細胞
臍帯血や胎盤組織中には多くの未分化細胞が存在することが知られています。我々は臍帯血の分離保存施設として、臍帯血バンクを管理運営する傍ら、採取量不足などで不合格となった臍帯血を利用して臍帯血中に含まれる造血幹細胞以外の未分化細胞を、細胞表面抗原マーカーなどを用いて分離同定する研究を行っています。
その研究成果の一つとして、臍帯血や臍帯組織中に発生過程の神経堤(neural crest)マーカーを発現している細胞群が存在し、この細胞は高い自己複製能を有するとともに神経細胞やグリア細胞に効率的に分化しうることなどを明らかにしています(慶応義塾大学 岡野栄之研究室との共同研究)。
このような臍帯血や胎盤組織の一部に存在する神経堤由来細胞は、神経再生治療の有効な細胞ソースとして期待できることから、現在難治性神経疾患に対する細胞治療の臨床応用を目指した研究を展開しています。
また胎盤間葉組織には母児間の免疫寛容の成立に重要な免疫制御細胞や間葉系幹細胞(MSC)が豊富に存在すると考えられていますが、その局在や形質など不明な点が多く残されています。
我々の研究グループでは、臍帯血、臍帯組織中に存在する未分化多能性細胞のスクリーニングを行い、同定した多能性細胞を細胞ソースとする新しい再生医療の開発や、難治性免疫疾患に対する細胞治療の開発を行っています。
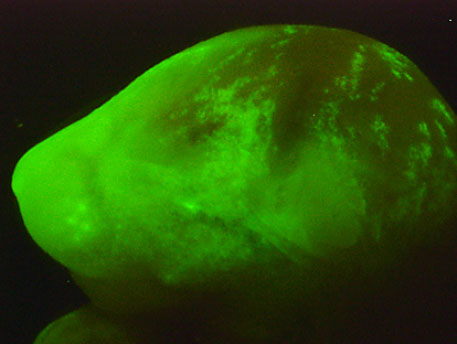
神経堤由来細胞をトレースできるP0Cre/Floxed-EGFPマウス
小腸不全に対する根治治療は未だ確立されておらず、生命維持手段として終生静脈栄養に依存せざるをえないのが現状です。近年のめざましい再生医学研究の発展にもかかわらず、小腸が粘膜上皮と神経筋層からなる複雑な管腔臓器であること、細胞移植に必要なニッチ(足場)が多くの場合失われていることなどから、小腸再生は非常に困難だと考えられています。
我々の研究グループではマウスES細胞から胚様体を形成させ、腸管上皮幹細胞を含む腸管組織を効率よく誘導する培養法を明らかにしました(Konuma N et al. Stem Cell Develop 18:113-125. 2009)。
また小腸特異的遺伝子CDXを大腸上皮細胞株やマウス大腸組織に強制発現させることにより、小腸吸収上皮細胞への分化転換が可能であるか検討を行っています。
このような取り組みは小腸不全に対する新しい治療戦略を開拓する上で重要な意義があると考えています。
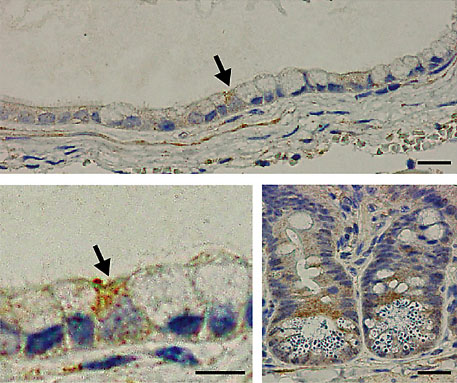
マウス腎皮膜下に構築されたES細胞由来腸管様構造とMusashi-1陽性腸管上皮幹細胞(矢印)
再生医療は臓器不全に対する次世代の治療として期待されていていますが、細胞移植再生医療の実現化には未だ多くのハードルがあります。
幹細胞や前駆細胞は胎生期の器官形成に関わっていることがよく知られていますが、心臓や腎臓などの成人の分化臓器にも微量ながら存在し、自己修復細胞として組織再生を起こすことが明らかになってきました。また血管内皮前駆細胞(EPC)は高血圧症、糖尿病などの疾患による血管傷害を修復しており、骨髄や末梢血中だけでなく血管外膜壁にも存在することが報告されています。
我々はこれまで高血圧患者さんを対象とした臨床試験や高血圧ラットを用いた実験において、抗酸化薬剤であるアンジオテンシンII受容体拮抗薬(ARB)やHMG-CoA還元酵素阻害薬(スタチン)が組織幹細胞や前駆細胞の機能を高める事を見いだし、既存薬剤による自己修復細胞の機能を高める保存的再生医療として提唱しています(Yao EH et al. Hypertens Res 30:1119-1128, 2007, Yu Y et al. Am J Hypertens 21:72-77, 2008, Matsumura M et al. J Atheroscler Thromb 16:319-326, 2009)。
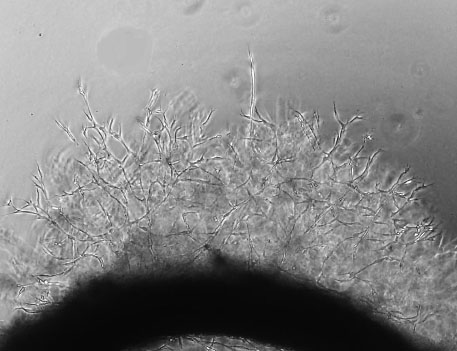
ラット大動脈リングを用いた血管新生アッセイ
さらに幹細胞やEPCの機能を高める薬剤、食習慣を確立し、これを啓蒙することにより抗老化医療として社会還元する研究プロジェクトを日本大学薬学部や武庫川女子大学国際健康研究所と行っています。
ピロール・イミダゾール(PI)ポリアミドはゲノム化学に基づき抗生物質から発見された低分子有機化合物です。我々は京都大学と共同で2003年より新規遺伝子制御薬として創薬を開始しました。
PIポリアミドは 有機化合物であるため生体内で安定であり、ベクターなしに細胞の核に取り込まれるといった特徴をもつユニークな転写活性抑制薬です。我々は進行性腎障害、血管再狭窄、癌などに対し、TGF-β1、LOX-1、CTGF、免疫グロブリンFc受容体をターゲットとしたPIポリアミドを分子設計、合成し、小動物での効果を確認し、現在前臨床試験を行っています(Matsuda H et al. J Am Soc Nephrol 17:422-432, 2006, Yao EH et al. Hypertension 52:86-92, 2008, Ueno T et al. J Hypertens 27:508-516, 2009)。
今後は製薬会社と共同で大量合成法を開発し、PIポリアミドの物性を確認した後、GMP、GLPグレードでの製薬を行い、薬剤としての実用化を目指したいと考えています。
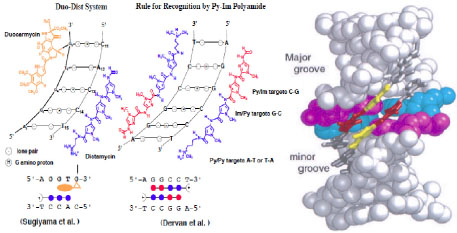
ピロールイミダゾール(PI)ポリアミドの構造
VEGFとその受容体(VEGFレセプター)システムは、生理的・病的血管新生や血管透過性の調節に中心的な役割を果たしていることが知られています。
我々の研究グループはスウェーデンウプサラ大学との共同研究として、VEGFレセプター2シグナル伝達経路の解析を行っています。今までの研究成果としてVEGFレセプター2細胞内ドメインのチロシン951が主要リン酸化部位であり、この部位のリン酸化はアダプター蛋白TSAdの結合を介して血管内皮細胞の遊走や血管新生を制御していることなどを明らかにしています(Matsumoto T et al. EMBO J, 24:2342-53, 2005)。
現在VEGFレセプター2チロシン951-TSAd経路がVEGFによる血管透過性亢進を制御する重要な経路であることが解明されつつあり、これを確証するためにTSAdノックアウトマウスやVEGFレセプター2チロシン949点変異を有する遺伝子改変マウスの形質解析などを行っています。これらの研究はがんの転移や腹水貯留など対する新規分子標的治療法の開発につながるといった点で大きな意義をもつと考えています。
また我々は、プロテオミクスの手法を用いて血管内皮細胞管腔形成を制御するタンパク分子の網羅的解析を行い、Chloride intracellular channel 4 (CLIC4), αB-crystallin, Nineinなどの管腔形成に重要な役割を果たすタンパク分子群を同定しています。微小管結合蛋白であるNineinは、特に発芽的血管新生時の先端細胞(Tip-cell)や腫瘍内血管内皮細胞に豊富に発現し、リン酸化を受け、内皮細胞の極性変化を制御していることが明らかになっています(Matsumoto T et al. Arterioscler Thromb Vasc Biol, 28:2123-2130, 2008)。
現在、nineinのチロシンリン酸化部位の同定および血管新生因子による活性化機序などについて検討を行っています。
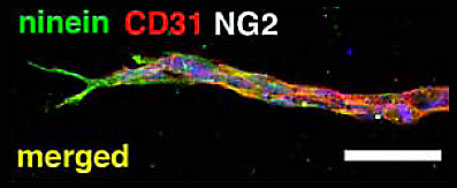
マウスES細胞由来Tip-cellにおけるNineinの発現
高血圧症では組織アンジオテンシン(Ang) IIにより心血管腎臓において心筋、血管平滑筋、メサンジウム細胞の肥大をおこし、酸化ストレスにより血管内皮細胞障害を起こします。
我々はマイクロアレイなどを用いた解析により、遺伝的高血圧ラット(SHR)の血管平滑筋細胞は遺伝的に補体C3を産生し、産生されたC3はKLF-5の転写活性を増加させ、血管平滑筋細胞の形質を合成型に変換し、カテプシンや変換酵素が増加してAng IIを産生し、過剰増殖を示す事を見出しました(Lin ZH et al. Hypertension 44:42-47, 2004, Wan JX et al. J Cell Physiol 213:495-501, 2007, Yao EH et al. Biochem Biophys Res Commun 367:468-473, 2008)。
今後更に、そのメカニズムを追求していきたいと考えています。また心血管病、進行性腎障害、高血圧症、動脈硬化症、メタボリック症候群などの病態解明の研究を腎臓高血圧内分泌内科分野と共同で行っております。特に高血圧症での血管リモデリング機序、メタボリックシンドロームや高血圧関連遺伝子の探索、体内時計遺伝子と肥満の関連、内臓脂肪組織と皮下脂肪組織における前駆脂肪細胞キャラクターの比較検討、脂肪組織で高発現しているHsp70, CCR1の機能などについて解析を行っています。
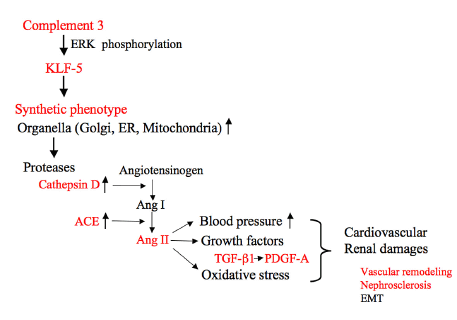
補体C3によるアンジオテンシン(Ang) II発現メカニズム