

イモリなどの有尾両生類は高い組織再生能がある動物として知られていますが、その組織再生機序として終末分化した細胞の脱分化現象が関与していることが明らかにされています[1]。
たとえばイモリの四肢が切断されると、断端の筋細胞が脱分化をおこし、多分化能と増殖活性を持った再生芽細胞と呼ばれる細胞に変化します。この再生芽細胞が増殖したのち、骨、血管、神経など多様な組織に分化することにより、数週間の経過で肢が元通りに再生することがわかってきました。このような終末分化細胞の脱分化現象は、ほ乳類では起こらないと一般的に考えられています。
我々は、ヒトを含むほ乳類の脂肪組織から単離した成熟脂肪細胞を天井培養という方法で体外培養することにより、生じてくる線維芽細胞の様な形態をした細胞群が、高い増殖能と多分化能を獲得することを明らかにしました(加野浩一郎 国際特許出願PCT/JP2004/007322)[2]。
これは一端終末分化した細胞でも適切な環境下で培養することにより、人工的に未分化な細胞へと脱分化させることが可能であることを意味しています。この成熟脂肪細胞に由来する多能性細胞を我々は、脱分化脂肪細胞(dedifferentiated fat cell : DFAT)と名付けました(図1)。
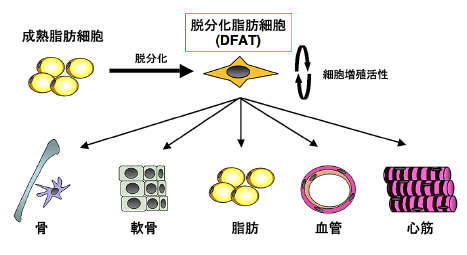
図1.成熟脂肪細胞に由来する脱分化脂肪細胞 (DFAT)
天井培養の概要を下図に示します(図2)。1〜2gの脂肪組織を採取し、コラゲナーゼ処理およびフィルトレーションを行った後、低速度遠心分離を行います。この過程で成熟脂肪細胞は脂質を多く含み浮遊してくるため、他の細胞群と分離することができます。
浮遊した成熟脂肪細胞分画を採取し、培地(20%FBS/DMEM)で満たしたフラスコ中で培養を行います。培養後2、3日の経過で成熟脂肪細胞はフラスコ天井側に付着し、細胞分裂により線維芽細胞様の形態を示すDFATが産生されます。
産生されたDFATは分裂増殖を繰り返し約1週間の経過でコロニーを形成してきます。コロニー形成が認められた時点で培地を交換し、フラスコを反転させて通常の付着培養を行うことにより、DFATはさらに活発に増殖し、約2週間の経過でコンフルエントの状態に到達します。
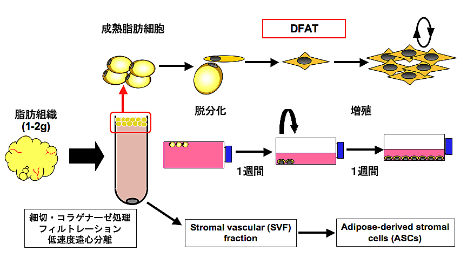
図2.DFATの調製法
タイムラプス顕微鏡を用いた観察によりDFATは、成熟脂肪細胞の非対称分裂によって産生されることが明らかになっています(図3)[2]。
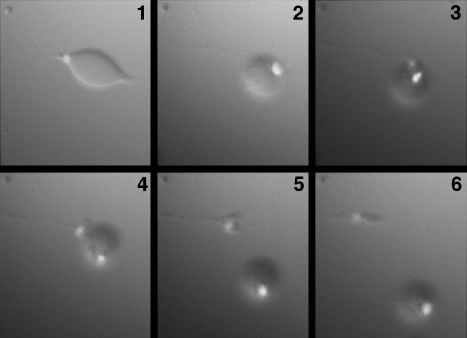
図3. 天井培養による成熟脂肪細胞の非対称分裂
一方、脂肪組織に由来する多能性細胞として近年注目されている脂肪組織由来幹細胞(adipose-derived stem/stromal cell : ASC)は、脂肪組織中の成熟脂肪細胞以外の分画(ストローマ分画)を付着培養して得られる細胞群であることから、DFATとは異なった細胞群であるといえます。
DFATではLPL、Leptin、GLUT4などのいわゆる成熟脂肪細胞マーカーの発現が完全に消失しています。一方、成熟脂肪細胞には通常発現していないRunx2, Sox9、平滑筋aアクチンといった、骨、軟骨、平滑筋の初期分化マーカーの発現が認められることから、DFATはいわゆる間葉系前駆細胞の形質をもった細胞群であると考えられます。
DFATの細胞表面抗原は、培養骨髄間葉系幹細胞(bone marrow mesenchymal stem cell : BM-MSC)やASCにほぼ一致した発現プロファイルを示します(図4)[2]。また皮膚線維芽細胞(Dermal fibroblast)ともかなり類似したパターンを呈することが明らかになっています。
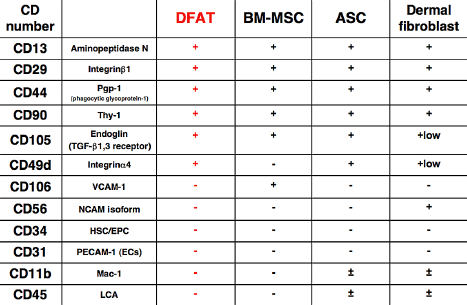
図4. DFATの細胞表面抗原プロファイル
適切な分化誘導培地にて培養することにより、DFATは脂肪細胞、骨芽細胞、軟骨細胞、骨格筋細胞、筋線維芽細胞などに分化します[2-6]。我々は一個の細胞から増殖させたDFATを用いた実験を行い、DFATが脂肪細胞、骨芽細胞、軟骨細胞に分化することから、クローンレベルで多分化能を有することを証明しています(図5)[2]。
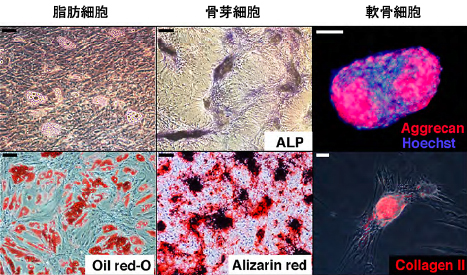
図5. DFATはクローンレベルで脂肪・骨・軟骨に分化する
また、DFATは沿軸中胚葉に由来する細胞のみならず、臓側中胚葉に由来する血管内皮細胞、血管平滑筋細胞、心筋細胞へ分化転換させることが可能です[7]。
さらに、傷害部位へDFATを移植することにより、下肢虚血モデルにおける血流改善作用、心筋梗塞モデルにおける心機能改善作用、脊髄損傷モデルにおける運動機能改善[8]、慢性腎障害モデルにおける腎機能改善[9]、尿道括約筋障害モデルに対する排尿機能改善作用[10]、骨粗鬆症モデルに対する骨密度増加作用[11]、皮膚全層欠損モデルにおける人工真皮移植後の皮膚再生促進作用[12]など幅広い組織修復能を示すことが明らかになっています。
BM-MSCやASCのように成体組織に微量に存在する幹細胞を付着培養後、増殖させ得られる細胞群に比べ、DFATは、①成熟脂肪細胞分画から調製される細胞であることから、煩雑な選別操作なしで純度の高い細胞が得られる(図6)。②組織採取量が微量(1g以下)ですむことから、全身状態が不良な患者や高齢者などからも調製できる。といった優位性があります。

図6.DFATとBM-MSC・ASCとの比較
DFATはBM-MSCやASCに比べ純度が高い細胞集団が得られる。
またDFATはiPS細胞のような全能性は獲得していませんが、遺伝子操作やウイルスベクターなどを用いない簡便な方法で短期間に大量調製が可能であるため、再生医療用ドナー細胞として早期の臨床応用が期待できます(図7)。
さらに外科手術時に廃棄される脂肪組織を利用することにより、バンキングシステムの構築も容易であると考えています。
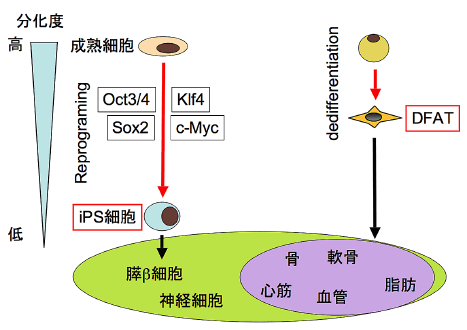
図7.DFATとiPS細胞の比較
DFATはiPS細胞に比べ分化度が高いため、分化能はほぼ中胚葉系に限られる。
一方DFATはiPS細胞より調製効率が高く、また腫瘍原性が低いと考えられる。
DFATは少量の脂肪組織から年齢を問わず調製が可能であることから、重症心不全や高齢者など、いままで自己幹細胞移植が困難と考えられてきた患者に対する新規再生医療用ドナー細胞として有望であります。臨床応用に関しては、骨、軟骨、血管、心筋、平滑筋といった中胚葉由来組織の再生医療に幅広く適応できると考えています。我々は高齢者に頻発し、特に有効な治療法がなく罹患すると著しくQOLを損なう疾患、具体的には難治性末梢動脈疾患(PAD) や、骨粗鬆症に伴う骨折などを対象とした細胞治療法の確立を目指して現在研究を進めています。さらに変形性関節症に対する軟骨再生、萎縮性膀胱に対する膀胱尿道平滑筋再生、重度熱傷などの難治性皮膚潰瘍に対する皮膚再生など多くの疾患への適応が期待されます。
これまでに文部科学省 私立大学戦略的研究基盤形成支援事業や科学技術振興機構(JST) 大学発新産業創出拠点プログラム(START) の研究助成を受け、DFAT細胞治療の臨床応用に向けた研究開発を行ってきました。平成30年度からは日本大学理事長特別研究に採択され、DFATを用いた歯科領域や獣医領域の細胞治療の開発など学部横断的な実用化研究を展開しています。
また平成30年度からは日本医療研究開発機構(AMED) 再生医療実用化研究事業の助成を受け、重症下肢虚血に対する血管再生療法の治験に向けた準備をしてきました。そして令和2年2月には「重症下肢虚血患者に対する自家DFATを用いた血管再生治療」のFirst-in-Human臨床研究を開始するに至っています。